周旭明团队在动物生态和进化发育等领域取得部分进展
(1)探究蝙蝠独特适应性特征分子基础及演化历史:中国科学院动物研究所周旭明研究员团队利用新测序和组装了17个蝙蝠和2个近缘物种的基因组探究蝙蝠独特适应性特征分子基础及演化历史。通过比较基因组学研究,研究发现蝙蝠新获得的某些DNA区域表现出增强子信号,能够促进与线粒体能量代谢相关基因的高表达,而能量的高消耗正是飞行所必需的。同时,该研究还确定了蝙蝠总科和兔唇蝠总科的分类地位,并证明阳蝙蝠亚目长期存在争议的系统关系主要是由不完全谱系分化引起的,而基因流动只起到了次要作用。进一步的正选择分析及细胞实验发现,许多与抗病毒相关的正选择基因同时具备抑制癌细胞迁移的功能,暗示蝙蝠在病毒耐受性与抗癌特性之间可能存在关联性。这些遗传机制的阐明不仅加深我们对蝙蝠的应性特征的全面理解,还为其他动物的适应性特征的遗传机制研究提供了新的研究思路。
相关成果以题为“Comparative genomics provides insights into adaptive evolution and demographics of bats”发表于Molecular Biology and Evolution(https://academic.oup.com/mbe/advance-article/doi/10.1093/molbev/msae208/7893330?searchresult=1)。中国科学院动物研究所助理研究员刘高鸣、博士生潘琪、副研究员朱平芬以及华大基因郭欣雨为共同第一作者,中国科学院动物研究所周旭明研究员为通讯作者。广州大学余文华教授、南京师范大学Inge Seim教授以及华大基因范广益研究员参与此项研究工作。该研究工作得到科技部重点研发计划(2021YFC2301300),国家自然科学基金(32070528和8205002),北京市自然科学基金杰出青年基金(JQ19022)以及中国科学院重点部署项目(KJZD-SW-L11)的支持。
(2)发展一种新的动物遗传负荷指标:遗传多样性是生物多样性保护的核心内容之一。周旭明团队提出了一种新的统计指标(连锁负荷指标:LD和nLD),用以评估群体基因组水平的连锁不平衡。通过连锁负荷指标,研究者能够更为精确地衡量种群的遗传结构和生存潜力,从而支持跨物种比较。该研究通过大量的模拟验证,这个新指标可以有效体现不同演化作用的影响,它随着重组率、协同上位程度、以及bottleneck大小的增大而单调变化;这个新指标降低了数据类型要求,不依赖于单倍型信息,并且在三种历史模拟下,都与基于单倍型估计的经典指标保持了一致的规律;这个新指标还控制了不同频率的突变的变动范围,确保低频突变的信号不至于被较高频突变的信号覆盖,因而表现出较好的稳定性和可比性。这一创新性的指标不仅有助于评估物种的绝灭风险,还可以为确定保护行动的优先级提供重要参考依据。
相关研究结果以题为“Genetic linkage disequilibrium of deleterious mutations in threatened mammals”发表在EMBO Reports(https://www.embopress.org/doi/epdf/10.1038/s44319-024-00307-2)。中国科学院动物研究所博士研究生胡春燕和助理研究员刘高鸣为相关论文的共同第一作者,周旭明研究员为论文的通讯作者。这些研究得到科技部国家重点研发项目(2023YFC3304000)、国家自然科学基金(32270437)和中国科学院动物研究所自主部署项目(2023IOZ0104)的资助。
(3)发现裸鼹鼠缺氧适应和肿瘤抑制中双重作用因子:动物中一些特异性的表型固定与环境适应之间的关系尚不明确,例如寿命、肿瘤抗性、社会组织模式等表型对物种适合度的贡献难以度量。从跨物种的角度,也就是进化的尺度下,来比较不同物种的相关物种的遗传机制会带来一个理论上的困境,即相关表型的分子变异是否受到自选选择的作用。周旭明研究员团队通过对长寿啮齿动物裸鼹鼠和小鼠的胚胎成纤维细胞应对缺氧时差异表达基因进行时空表达组学分析,发现组蛋白H1.2(由HIST1H1C编码)在裸鼹鼠胚胎成纤维细胞(NEFs)和小鼠胚胎成纤维(MEFs)中为差异表达,且NEFs中较高的H1.2表达与其上游抑制基因PARP1的较低表达相关。进一步机制探究表明H1.2可以直接与HIF-1α PAS结构域相互作用,从而通过与HIF-1β的二聚化来促进HIF-1α的表达。此外,研究发现过表达H1.2通过NRF2/P62信号通路触发自噬并抑制癌细胞的迁移以及异种移植肿瘤的形成。最后,对H1.2敲入的转基因小鼠进行低氧胁迫生存实验发现其在低氧条件(4% O2)下生存时间显著延长且通过肿瘤移植实验发现其可以延缓肿瘤的形成。
该研究结果表明H1.2与缺氧适应和肿瘤抑制的双重现象之间存在潜在的机制联系。相关结果对于物种的缺氧适应、肿瘤免疫具有重要作用,同时也为抗肿瘤药物的开发提供新的靶点。同时相关结果提示动物抗肿瘤特性可能不受自然选择的直接作用,而可能是由于这些动物在调整相关通路以应对不同生境过程中所产生的“搭便车效应”产生,并得以长期维持。相关研究成果以题为 “Comparative time-series multi-omics analyses suggest H1.2 involvement in anoxic adaptation and cancer resistance”的研究论文发表在在PLOSBIOLOGY(https://journals.plos.org/plosbiology/article?id=10.1371/journal.pbio.3002778#abstract0)。中国科学院动物研究所博士研究生(现山西大学教师)杜娟、刘伟强和助理研究员李萌为共同第一作者,周旭明研究员为通讯作者。该研究得到了国家自然科学基金原创探索专项、北京市自然科学基金杰出青年和中国科学院动物研究所自主部署项目的资助。
(4)揭示脊索动物神经系统的双端起源轨迹:脊椎动物拥有复杂的神经系统,目前,人们对脊椎动物神经细胞类型的演化以及无脊椎动物和脊椎动物之间中枢神经系统(CNS)发育的差异仍然了解甚少。中国科学院动物所周旭明研究员、厦门大学生命科学学院李光教授、和牛津大学生物系Sebastian Shimeld教授团队通过构建文昌鱼七个胚胎发育阶段的单细胞谱系,成功识别了一组神经垂体样神经元和下丘脑样神经元,推演了整个文昌鱼胚胎发育的细胞命运轨迹。研究人员利用CRISPR/Cas9、TALEN等基因编辑手段,针对性敲除了细胞命运轨迹预测出的不同转录因子基因,论证了利用生物信息学手段推算出的文昌鱼前、后端神经系统发育轨迹,为揭示脊椎动物神经系统的演化过程提供了清晰而直接的证据。该研究首先分析了小鼠、斑马鱼、海鞘、海胆和海葵等物种的胚胎单细胞数据,探究了脊椎动物神经系统的三种发育起源模式。然后重点比对了文昌鱼-斑马鱼细胞簇的相似性,其中SAMap算法将文昌鱼中枢神经系统前端祖细胞映射到斑马鱼中枢神经系统前端祖细胞,并且预测的后部祖细胞在物种之间对齐。为了进一步探究推演的中枢神经发育轨迹,团队利用CRISPR/Cas9基因敲除技术针对性敲除了文昌鱼细胞分化和中枢神经系统发育至关重要的几个转录因子基因。此外,研究人员在文昌鱼尾芽中发现了一组 NMP 细胞,它们共同表达脊椎动物 NMP 标记 SoxB1c 和 Bra2,并且研究人员观察到在 Brachyury 双敲除胚胎中,神经基因表达从后神经和神经中胚层细胞簇“溢出”到一般尾芽簇,支持 Brachyury 转录因子可能介导抑制文昌鱼神经基因表达,与 Brachyury 抑制脊椎动物神经标记基因表达的功能一致。
相关研究结果以题为“Evolutionary origin of the chordate nervous system revealed by amphioxus developmental trajectories”发表在Nature Ecology & Evolution(https://www.nature.com/articles/s41559-024-02469-7)。中国科学院动物研究所周旭明研究员、厦门大学生命科学学院李光教授和牛津大学生物系Sebastian Shimeld教授为论文共同通讯作者。中国科学院动物研究所博士后戴漪晨为该文第一作者。该研究得到国家自然科学基金、中国博士后管理委员会博士后引进项目、中国科学院动物研究所秉志博士后计划等经费支持。
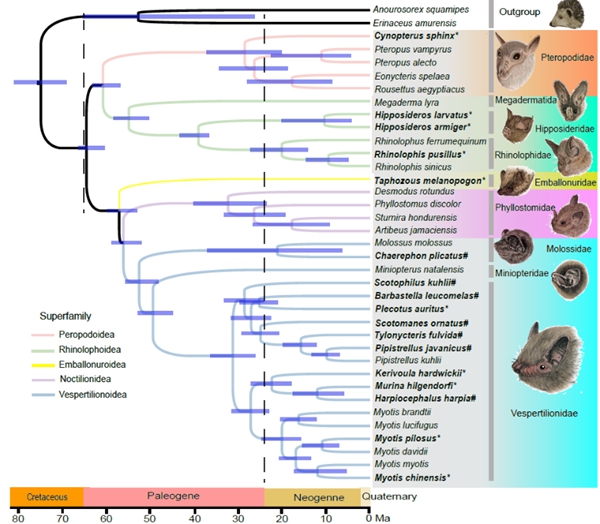
图1 蝙蝠的系统发育和分化时间
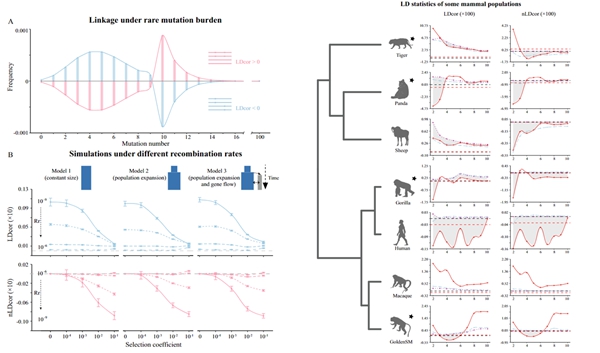
图2:新指标在相关物种遗传数据中的测试
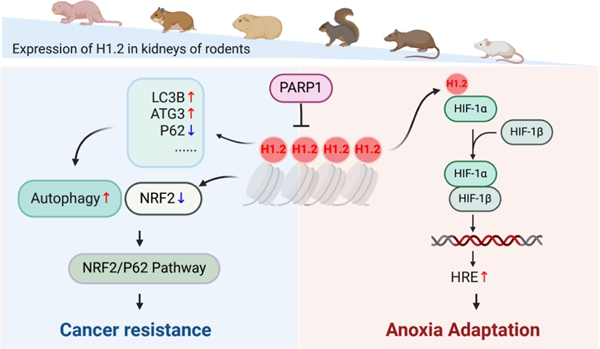
图3 H1.2在缺氧适应和肿瘤抑制中的双重功能示意图
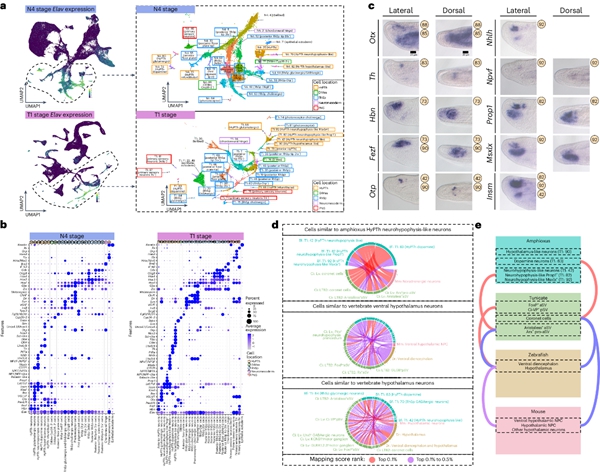
图4 文昌鱼神经胚阶段神经细胞类型的所有细胞簇
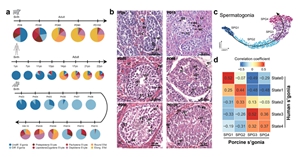
动物模型在研究人类疾病(如不孕不育)中至关重要。近期研究显示,啮齿动物模型(如小鼠)与人类在睾丸细胞组成、分子特征和发育轨迹等方面存在显著差异,这凸显了寻找替代动物模型的必要性,以更准确地模拟人类...

生物体的精密组织结构的形成,依赖于数十亿细胞在器官、系统乃至整个生物体中的协同作用,这些细胞共同维系着生命活动。而衰老是一个复杂、异质、异步和非线性的过程,通常伴随着细胞功能的下降和紊乱度的增加,...
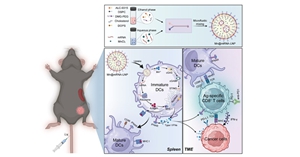
mRNA疫苗在抗击严重急性呼吸系统综合症冠状病毒2(SARS-COV-2)传染病中的成功,凸显了该技术在应对突发性传染病中的应用价值。近些年,mRNA抗肿瘤疫苗的研发也愈发引人注目,因其研发周期短、可实现个性化设计等...

