郭靖涛/于乐谦团队合作利用3D重构解析人类原肠运动早期发育过程
人类早期原肠运动决定了细胞如何精确地迁移、定位和分化,形成正常的多胚层结构及器官系统,因此研究人类早期原肠运动的分子规律,对于理解胚胎发育的基本机制至关重要。原肠运动的分子机制涉及细胞间信号传递与基因表达的调控,这些都直接影响到个体发育的精确性和稳定性。深入探讨这些分子规律,能够揭示发育异常和先天性畸形的根源,提升我们对人类健康和疾病治疗的理解。人类原肠胚形成始于胚胎第14-15天(Carnegie stage,CS6-7),在约第21天(CS9)结束【1】,最终形成三层胚层:外胚层、中胚层和内胚层。然而,早期原肠胚形成的研究仍较为有限,目前仅有少数涵盖CS5到CS11阶段的非人类灵长类胚胎的单细胞转录组数据集。最近,同一研究团队对人类CS8时期胚胎进行了关键事件的研究【2】,但许多早期原肠胚事件如前后轴的建立和原始生殖细胞特化等已在更早阶段发生。当前唯一可用的关于人类早期原肠胚的数据集是CS7阶段的单细胞转录组数据【3】,包含1,195个细胞,定义了不同细胞类型,并为体外胚胎模型提供了参考。然而,由于缺乏精确空间信息,细胞类型定义面临挑战。
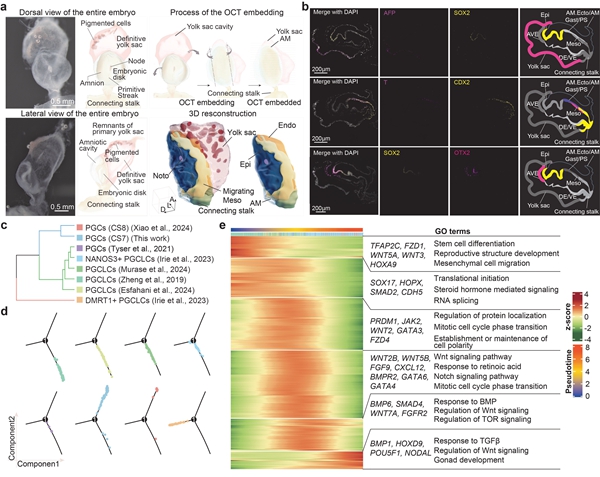
2025年1月10日,中国科学院动物研究所郭靖涛研究员、中国农业大学魏育蕾教授、北京理工大学肖振宇副教授、及中国科学院动物研究所于乐谦研究员合作在Nature Cell Biology上发表了文章Spatial Transcriptomic Characterization of a Carnegie Stage 7 Human Embryo。研究团队基于CS7时期完整人类胚胎,利用连续横断面(transverse plane)高分辨空间转录组切片,结合深度学习算法进行三维对齐,形成了完整胚胎中不同细胞类型与基因表达的三维空间分布点云图,数字3D重构了首个完整人类原肠胚模型。
人的生命始于精子与卵子融合形成受精卵(胚胎期第0天;Embryonic day 0;E0),受精卵经历卵裂形成囊胚,囊胚在E7左右种植到母体子宫进一步发育。E14开始,胚胎经历原肠运动,胚胎后部细胞发生大规模定向迁移,并形成原条细胞【4】。
本工作发现,胚胎前部细胞分化为外胚层,尽管原条细胞在早期所有类群中都同时具有TBXT/MIXL1等原条的marker,但依据空间位置和DEG进行进一步分群,能发现不同空间位置上就已经开始出现不同类型中胚层的marker表达,证明在原肠运动早期胚胎就已根据的不同有了谱系分化的倾向性。这些在原条细胞类群中从前端自后端可以再细分出的类群包括表达CYP26A1和NODAL的轴向中胚层(Axial Mesoderm)、表达FOXC1/FOXC2的近轴中胚层(Paraxial Mesoderm)、表达HAND1的侧板中胚层(Lateral Plate Mesoderm)/胚外中胚层前体细胞(Extraembryonic Mesoderm progenitor)等。
在胚胎发育的早期阶段,前内脏内胚层(Anterior Visceral Endoderm,AVE)的迁移行为对于确定胚胎的前后轴向至关重要。AVE不仅在迁移模式上与周围的内脏内胚层(Visceral Endoderm,VE)有所不同,还具有限制原始条纹在胚胎对侧形成的能力【5】。本研究中,研究者首次在人胚胎中证明了AVE的存在,并将该类群细胞与鼠、猴等物种跨物种比较,发现其特征marker非常保守,包含DKK1/OTX2等重要抑制因子和转录因子的表达。
最后,该研究借助3D重构原肠胚模型探讨了人类原始生殖细胞(Primordial Germ Cells,PGCs)的分子特性。研究发现PGCs在CS7时期位于胚胎尾端,且可能源自外胚层衍生的细胞。通过与体内PGCs、体外人类原始生殖细胞样细胞(Human Primordial Germ Cell-like Cells,hPGCLCs)对比,验证了CS7和CS8时期的PGCs在转录组特征上与hPGCLCs高度相似(除DMRT1+ hPGCLCs外),进一步揭示了体内和体外PGCs在发育过程中的分子变化,为理解和优化PGC的培养条件提供了重要的见解。
综上所述,该研究中基于82个连续的冷冻切片进行Stereo-seq测序,重建了人类CS7胚胎的三维模型。本研究发现了不同中胚层亚型的早期命运决定以及前内脏内胚层的存在。本研究还发现原始生殖细胞位于Connecting stalk中,以及在卵黄囊中观察到造血干细胞来源的造血现象。这项研究推动了我们对人类原肠胚发育的理解,并为未来早期人类发育研究提供了宝贵的数据集。此外,鉴于3D模型以论文图片形式展示的挑战,为了便于更多读者理解和使用研究结果,论文作者们还同时建立并发布了可互动共享网站:cs7.3dembryo.com.
原文链接
https://www.nature.com/articles/s41556-024-01597-3

雄性动物睾丸的主要任务是产生精子——这是形态上最为多样化的真核细胞之一。精子发生的过程包括精原细胞自我更新、精母细胞减数分裂和精子变形等高度保守的机制,这些过程在物种间高度保守;与此同时,每个物种...

近日,中国科学院动物研究所赵莉蔺研究员团队在生态学国际期刊Global Change Biology在线发表了题为“Vulnerability of global pine forestry's carbon sink to an invasive pathogen-vector system”的研究成果...
胰岛素/IGF-1通路对多种动物寿命和衰老速度的影响已在包括线虫、果蝇和小鼠在内的多种模式生物中得到验证。同时,多项针对长寿人群的研究已证明人类衰老表型与胰岛素/IGF-1信号通路基因的遗传变异之间存在关联。

