中科院动物所合作揭示灵长类血管衰老的驱动力
心血管疾病(如动脉粥样硬化症)是人类健康的重大威胁,伴随衰老而发生的血管结构和功能的退行性改变是导致心血管疾病的主要危险因素。由于不同来源的血管壁细胞存在高度异质性,目前尚不明确人类老年血管的细胞组成和分子特征,这在一定程度上限制了人们对人类血管衰老机制的深入理解,并制约了心血管衰老及相关疾病干预手段的发展。
2020年5月5日,中国科学院动物研究所曲静研究组、刘光慧研究组与北京大学汤富酬研究组合作在Nature Communications杂志在线发表题为“A single-cell transcriptomic landscape of primate arterial aging”的研究论文。该研究以食蟹猴为研究对象,首次绘制了灵长类动脉血管衰老的单细胞基因表达图谱,进而揭示长寿基因FOXO3A的表达下调是血管衰老的驱动力。
主动脉弓和冠状动脉是人类动脉粥样硬化的易感部位。研究人员首先对年轻和年老食蟹猴的这些动脉血管进行了组织学分析。大尺度电镜三维重构等技术揭示年老血管呈现血管壁增厚、钙化、纤维化以及血管内皮细胞减损等衰老特征。为了进一步明确衰老伴随的不同类型血管细胞的分子改变,研究人员利用单细胞转录组测序技术绘制了主动脉弓及冠状动脉的内皮细胞、平滑肌细胞和成纤维细胞等血管细胞类型的基因表达图谱,并鉴定出8种区分主动脉和冠状动脉细胞的新型分子标志物。衰老伴随的差异基因表达网络分析显示,转录因子FOXO3A(长寿基因FOXO3A编码的蛋白产物)是调控动脉血管差异基因表达网络的关键分子节点。FOXO3A在六种衰老的血管壁细胞中表达均下调,是灵长类动脉血管衰老的重要特征。
在进一步的研究中,研究人员证实了FOXO3A对于维持灵长类动脉血管稳态的重要作用。通过结合胚胎干细胞基因编辑和定向诱导分化技术,研究人员获得了靶向敲除FOXO3A基因的人类血管内皮细胞。与野生型细胞相比,FOXO3A缺失的血管内皮细胞表现出增殖、迁移和成管等能力的退化。在被移植到小鼠的缺血后肢中后,FOXO3A缺失的内皮细胞的血管修复能力较野生型细胞也显著降低。
该项研究在国际上首次实现了灵长类血管衰老单细胞图谱的绘制,不仅深入解析了血管衰老过程中细胞组成和分子特征的变化规律,而且揭示了长寿基因FOXO3A表达水平的沉默是驱动灵长类动脉血管衰老的关键因素。这些发现为人类血管衰老及相关疾病的干预奠定了重要的理论基础。值得关注的是,研究团队近期已利用基因编辑技术获得了首例FOXO3A增强型人类血管细胞(Cell Stem Cell 2019,封面文章)。与FOXO3A缺失的血管内皮细胞相反,FOXO3A增强型细胞的血管修复和再生能力显著增强,为通过再生医学治疗血管退行性疾病提供了优质的细胞移植材料。
该项研究由中国科学院动物研究所、中国科学院北京基因组研究所、北京大学、中国科学院生物物理研究所、中国科学院自动化研究所、中国科学院干细胞与再生医学创新研究院、首都医科大学宣武医院等机构合作完成。中国科学院动物研究所曲静研究员、刘光慧研究员和北京大学汤富酬教授为文章的共同通讯作者。中国科学院北京基因组研究所张维绮研究员、北京大学博士研究生张书、中国科学院动物研究所博士研究生颜鹏泽和北京大学博士研究生任杰为并列第一作者。研究受到周琪院士、陈彪教授、孙飞研究员、李伟研究员和宋默识研究员的合作与支持,获国家科技部、国家自然科学基金委、中国科学院和北京市等项目资助。

图. 灵长类动脉血管衰老的细胞分子机制
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
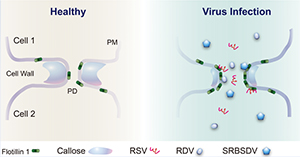
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

