赵方庆团队建立人工智能驱动的空间蛋白质组学新技术
近年来,空间组学技术已成为解析组织异质性和复杂细胞相互作用的重要工具。尤其是空间转录组学,在胚胎发育、神经科学和疾病机制研究中展现了巨大潜力。然而,作为直接执行生物功能的核心分子,蛋白质的空间分布研究在技术上面临诸多挑战。现有空间蛋白质组学技术受限于质谱检测通量和高昂成本,难以兼顾高分辨率与大面积组织分析需求,限制了其在复杂组织研究中的广泛应用。
2025年1月23日,中国科学院动物研究所的赵方庆团队在《Cell》发表了题为“High-resolution spatially resolved proteomics of complex tissues based on microfluidics and transfer learning”的研究论文。该研究提出了全新的空间蛋白组学技术框架——PLATO,通过整合人工智能深度学习算法与微流控技术,实现了全组织切片水平的高分辨率空间蛋白质组检测(25微米分辨率,数千个蛋白),突破了高通量原位组学技术的瓶颈。
现有空间蛋白质组方法主要依赖抗体染色或质谱技术,前者因靶标数量有限,仅能检测几十至几百种蛋白分子;而后者尽管检测种类丰富,但逐点取样的方式极大增加了实验成本和规模。例如,对1平方厘米的组织切片进行100微米分辨率的网格分析,需要检测上万个LC-MS/MS样本,远超出现有质谱检测通量的能力。
算法创新:基于“降维编码”与“升维解码”的空间重构算法
PLATO从断层扫描成像的重构原理汲取灵感,通过降维后的平行流投影(parallel flow projection)与深度学习算法Flow2Spatial相结合,成功重构出蛋白质的高分辨率空间分布。Flow2Spatial巧妙运用了自编码器模型,将平行流投影的实验过程模拟为“降维编码”,并通过整合其他空间组学数据(如组织学染色、空间转录组学等),对蛋白质空间分布进行高精度“升维解码”。这一原创算法突破了传统技术难以获取空间信息的限制,不仅大幅提高了空间蛋白质组的覆盖度和分辨率,还为解析其他组学分子的空间分布提供了新方案。
技术创新:基于微流控的平行流高效蛋白采样技术
在原位采样方面,PLATO结合微流控技术,开发了高通量、低成本的灵活采样平台,可实现25至100微米分辨率范围内进行精确采样。相比传统方法,PLATO通过并行原位采样显著提高了实验效率,同时降低了对复杂昂贵设备的依赖,使得这一技术更加经济实用,为复杂组织的高分辨率空间解析提供了可靠工具。
研究团队通过计算模拟、显微切割和免疫荧光验证了PLATO的高精确性,结果显示其能够准确重构组织切片中蛋白分子的空间分布,空间分辨率最高达到25微米。此外,针对不同类型样本(如冰冻切片和FFPE组织)分别建立了实验流程,证明了PLATO在多种组织类型中的广泛适用性。研究团队进一步对小鼠脑组织、肠道绒毛及乳腺癌等复杂组织进行了高分辨率蛋白质空间分布解析,进一步验证了其在不同应用场景及研究方向中的巨大潜力,为揭示蛋白质动态分布和探究复杂生物过程的分子机制提供了强有力支持。
PLATO以人工智能算法、微流控和质谱技术的深度融合,实现了空间组学技术的重要突破。随着技术迭代创新, PLATO有望成为推动生命科学研究的核心工具,并在疾病诊断、精准医学和农业生物技术等领域发挥重要作用。
中国科学院动物研究所博士后胡倍瑜、博士后何睿乔、博士研究生庞琨及国家蛋白质中心王贵宾为该研究的共同第一作者,中国科学院动物研究所赵方庆研究员和冀培丰副研究员为该研究的通讯作者。该研究得到了国家杰出青年科学基金、国家重点研发计划和北京市自然科学基金等项目资助。
文章链接:https://doi.org/10.1016/j.cell.2024.12.023
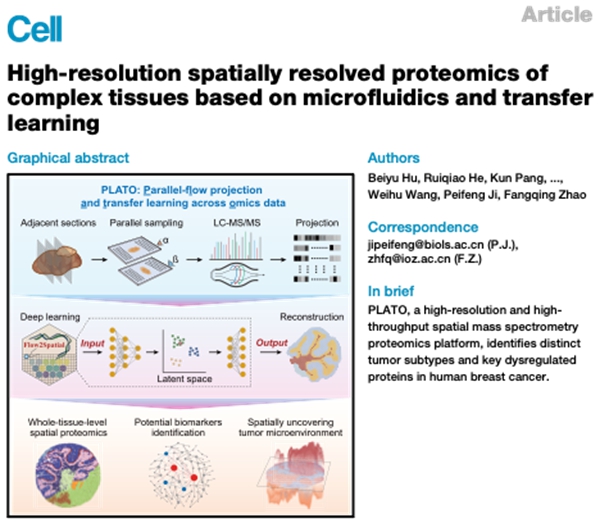
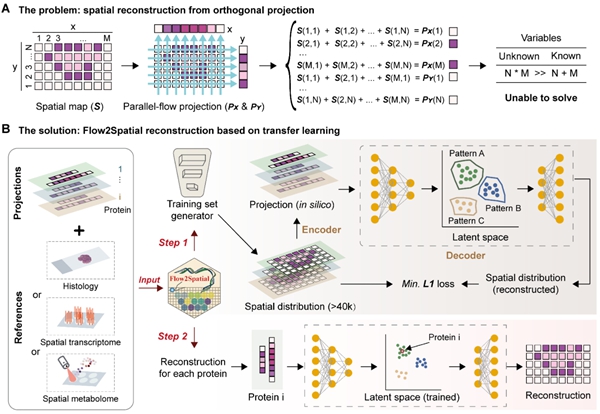
图1.基于深度学习算法的蛋白质空间分布重构流程图
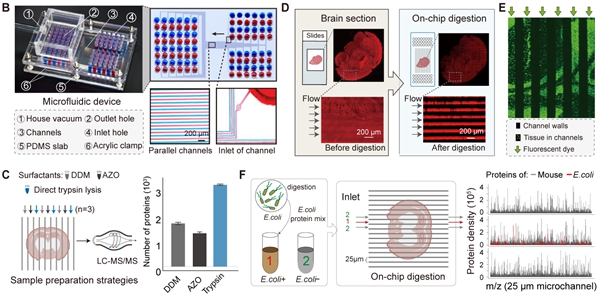
图2. PLATO的微流控芯片装置图和原位采样结果
人类早期原肠运动决定了细胞如何精确地迁移、定位和分化,形成正常的多胚层结构及器官系统,因此研究人类早期原肠运动的分子规律,对于理解胚胎发育的基本机制至关重要。
雄性动物睾丸的主要任务是产生精子——这是形态上最为多样化的真核细胞之一。精子发生的过程包括精原细胞自我更新、精母细胞减数分裂和精子变形等高度保守的机制,这些过程在物种间高度保守;与此同时,每个物种...

近日,中国科学院动物研究所赵莉蔺研究员团队在生态学国际期刊Global Change Biology在线发表了题为“Vulnerability of global pine forestry's carbon sink to an invasive pathogen-vector system”的研究成果...

