王金勇团队开发多能干细胞来源CRO-CD7 CAR-iNK细胞:避免自相残杀,延长体内续存、有效抑制T细胞肿瘤
NK细胞是一种固有免疫细胞,具有广谱杀伤肿瘤细胞的功能,可同种异体输注,与T细胞相比不易产生移植物抗宿主病(GVHD)和细胞因子释放综合征(CRS)等严重副作用。近年来,嵌合抗原受体NK细胞(CAR-NK)已在血液系统恶性肿瘤和部分实体瘤中显示出良好的抗肿瘤活性。人多能干细胞(hPSC),包括人诱导性多能干细胞(hiPSC)和人胚干细胞(hESC),具有无限来源和易于多重基因编辑的优势。相对于人体组织或NK细胞系来源的CAR-NK细胞,hPSC诱导分化来源的CAR-iNK细胞具备细胞均一性高、制备成本低、可规模化生产、冻存现货等符合成药性特点。目前,已建立类器官法诱导hESCs大规模再生iNK、MSLN CAR-iNK和低免疫原性CD19 CAR-iNK细胞的技术和生产工艺,部分细胞制剂已经推进到临床试验(IIT)阶段【1-3】。然而,同种异体CAR-NK细胞输注后存在体内续存时间短、疗效不持久等问题,亟待解决。
近日,中国科学院动物研究所、北京干细胞与再生医学研究院王金勇团队与上海同济大学梁爱斌、浙江大学钱文斌、协和医科院天津血液病医院竺晓凡等临床医学领域科学家合作,在Journal of Hematology & Oncology在线发表了题为Engineered CRO-CD7 CAR-NK cells derived from pluripotent stem cells avoid fratricide and efficiently suppress human T-cell malignancies的研究论文。T细胞急性淋巴细胞白血病(T-ALL)是一种侵袭性的恶性血液肿瘤。CD7蛋白在超过95%的T-ALL和30%的急性髓系白血病(AML)病人中高表达【4】。由于CD7蛋白也表达在正常的T和NK等细胞中,导致人体组织来源CD7 CAR-NK细胞间存在自相残杀,影响这些细胞的增殖和抗肿瘤效果。已有研究表明,消除CD7膜蛋白表达可有效避免CD7 CAR-T/CAR-NK细胞的自相残杀。特别地,在造血干细胞阶段敲除CD7基因并不影响T细胞和NK细胞的发育和功能【5】。
该研究利用国家干细胞资源库的临床级hESCs,利用中国科学院动物研究所开发的基因编辑工具,成功开发了CD7基因敲除、导入CD7 CAR的CAR-iNK(CD7 KO-CD7 CAR-iNK)细胞制备技术。首先利用基因编辑与基因工程技术在hESCs阶段实现CD7基因敲除并稳定表达CD7 CAR元件,随后通过类器官诱导技术诱导hESCs高效获得CD7 KO-CD7 CAR-iNK细胞。CD7 KO-CD7 CAR-iNK细胞可有效避免由CD7抗原介导的CD7 CAR-NK细胞的自相残杀行为,恢复NK细胞的正常增殖能力(图2),并对CD7靶点阳性的T-ALL肿瘤细胞系和病人来源的原代T-ALL细胞展现出高效、特异的细胞毒性。
研究表明,NK细胞在体外培养或制备过程中会导致CXCR4(在归巢至骨髓中起关键作用)的表达下调【6】。在CAR-NK细胞中过表达CXCR4,有望促进其归巢,通过与骨髓微环境互作提高存活、原位增殖和功能活性。该研究进一步在hESCs阶段过表达CXCR4,通过iNK类器官诱导技术【1】诱导产生过表达CXCR4的CD7 KO-CD7 CAR-iNK细胞(CRO-CD7 CAR-iNK)。体内生物发光活体成像追踪实验证实,CXCR4过表达能够有效延长CD7 KO-CD7 CAR-iNK细胞的体内续存时间(图3)。进一步,通过T-ALL细胞荷瘤小鼠模型证实,CRO-CD7 CAR-iNK细胞能够有效抑制T-ALL荷瘤小鼠的肿瘤生长,显著延长生存期(图4)。
综上所述,该研究通过基因编辑与基因工程成功构建敲除CD7基因并过表达CD7 CAR和CXCR4的CRO-CD7 CAR-hESCs,类器官法诱导其分化产生了免疫表型和功能正常、成功避免自相残杀的CRO-CD7 CAR-iNK细胞。CRO-CD7 CAR-iNK细胞细胞学水平上在体内外周血循环血的续存时间可延长至28天以上,并显著延长T-ALL细胞荷瘤小鼠的生存期。该研究开发了hESCs来源的CD7 KO-CD7 CAR-iNK细胞,克服传统CD7 CAR NK细胞自相残杀、增殖能力受损、体内持续性差等问题,为治疗CD7靶点阳性的T-ALL和AML恶性肿瘤提供了一种有前景的细胞制剂。
中国科学院动物研究所、北京干细胞与再生医学研究院王金勇研究员及其团队的张梦云副研究员、王童洁副研究员为该论文共同通讯作者,王金勇研究员团队的博士生林云轻、肖子芸为该论文共同第一作者。该研究得到科技部国家重点研发计划干细胞专项(2024YFA1108302)、国家自然科学基金委杰出青年基金(81925002)等项目资助。
原文链接:https://jhoonline.biomedcentral.com/articles/10.1186/s13045-025-01712-3
参考文献
1. Huang D,Li J,Hu F et al. Lateral plate mesoderm cell-based organoid system for NK cell regeneration from human pluripotent stem cells. Cell Discov 2022;8:121.
2. Zhang Q,et al. Hypoimmunogenic CD19 CAR-NK cells derived from embryonic stem cells suppress the progression of human B-cell malignancies in xenograft animals. Front Immunol. 2024;15:1504459.
3. Liu Y,et al. Mesothelin CAR-engineered NK cells derived from human embryonic stem cells suppress the progression of human ovarian cancer in animals. Cell Prolif. 2024;57: e13727.
4. Campana D,van Dongen JJ,Mehta A,Coustan-Smith E,Wolvers-Tettero IL,Ganeshaguru K,Janossy G. Stages of T-cell receptor protein expression in T-cell acute lymphoblastic leukemia. Blood. 1991;77:1546–54.
5. Kim MY,Cooper ML,Jacobs MT,Ritchey JK,Hollaway J,Fehniger TA,DiPersio JF. CD7-deleted hematopoietic stem cells can restore immunity after CAR T cell therapy. JCI Insight. 2021;6:e149819.
6. Beider K,et al. Involvement of CXCR4 and IL-2 in the homing and retention of human NK and NK T cells to the bone marrow and spleen of NOD/SCID mice. Blood. 2003;102:1951-1958.

图1
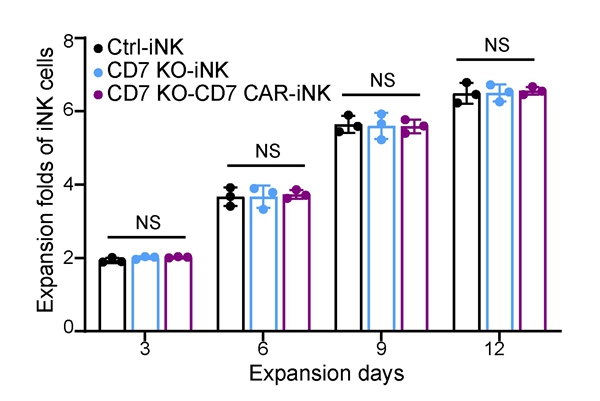
图2 CD7 KO-CD7 CAR-iNK细胞具备正常NK细胞扩增能力
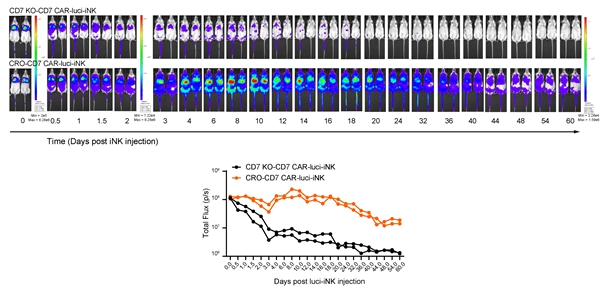
图3 CXCR4的过表达延长CRO-CD7 CAR-iNK细胞的体内续存时间
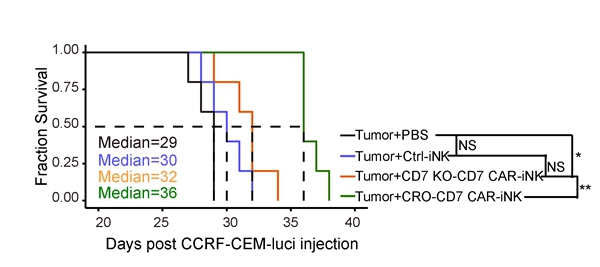
图4 CRO-CD7 CAR-iNK细胞显著延长T-ALL细胞荷瘤小鼠的生存期
饮食中加入适量盐能增添食物的鲜味,但是过多的盐摄入与人类多种健康问题密切相关,包括高血压、心血管疾病、肾脏纤维化、骨骼健康受损,以及癌症等。然而,有些野生动物在野外环境中终生取食高盐植物,却能够保...
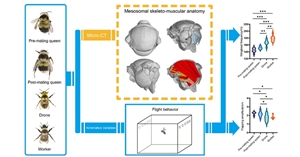
昆虫胸部作为飞行功能的核心结构,其外骨骼与特化的飞行肌系统通过直接和间接两种机制协同驱动翅运动。然而,现有研究往往将形态学特征(如肌肉排列、骨片结构)与飞行运动学参数(如振翅频率、运动轨迹)割裂分...

羽毛是鸟类征服天空的核心工具。羽毛演化经历了从恐龙简单的单根细丝状羽毛,逐渐变成复杂的羽片状羽毛,这个过程一般认为分为五个过渡阶段,每一个过渡阶段都是发展演化新特征或新的生长机制的结果。

