刘长梅团队揭示组蛋白修饰在脑疾病与神经再生中的关键功能与调控机制
神经系统是人体结构和功能最复杂的系统,作为人体的指挥中心,负责调控运动、学习、记忆、感知和情绪等多种功能。神经元是神经系统中最主要的细胞类型,承担着信号传导的核心任务。神经元在成熟后并非一成不变,它们对损伤和疾病极为敏感,如以神经元进行性丢失为特征的神经退行性疾病,这些疾病的核心症状是神经网络结构和功能的崩溃,最终导致记忆、认知、行为和运动功能的损害,神经功能的恢复依赖于神经再生和神经元功能的重建。
组蛋白修饰作为表观遗传调控的核心机制之一,近年来成为研究热点。组蛋白修饰通过化学修饰(如甲基化、乙酰化、磷酸化等)动态调控染色质结构和基因转录活性,从而影响神经干细胞的命运决定、神经元的功能成熟以及神经再生过程。其中,组蛋白H3第27位赖氨酸的三甲基化(H3K27me3)在大脑发育和神经再生中尤为重要。H3K27me3通常与基因沉默相关,通过调控关键基因的表达,精细调控神经系统的发育和功能。中国科学院动物研究所刘长梅研究组及其合作者围绕组蛋白修饰,开展了一系列的研究工作,揭示其在神经发育与神经再生中重要的功能以及调节机制。最新研究成果发表在Adv Sci (Weinh)。
1. 组蛋白修饰在原位神经再生中的调控机制
刘长梅研究组围绕 H3K27me3 展开深入研究,从 “组蛋白修饰” 层面逐步深入到 “基因功能” 层面,揭示了其在原位神经再生及神经发育调控过程中的功能与相应机制。通过筛选,发现急性损伤的神经再生模型中H3K27me3升高,进而围绕视神经节细胞的存活与再生,建立了多种相关的疾病模型,急性视神经损伤模型(RGCs存活和视神经再生)、NMDA模型(RGCs存活)和微球注射模型(青光眼高眼压模型),在此基础上,研究组与浙江大学周峰泉教授团队揭示了H3K27甲基转移酶EZH2通过调控H3K27me3修饰,激活轴突再生相关基因的表达,从而促进RGCs的存活和轴突再生(Journal of Clinical Investigation,2024),提示H3K27me3升高有利于神经再生。研究组与合作团队通过两种H3K27me3去甲基化酶 UTX/JMJD3的缺失,进一步探究了其在神经保护和轴突再生中的功能。结果显示缺失 UTX 或 JMJD3 会导致周围神经系统 (PNS) 中的轴突原位再生能力增强,而在中枢神经系统 (CNS)中,只有UTX在RGCs 中缺失后会增强视神经再生的功能,但是UTX/JMJD3都具有调节 RGCs 存活的功能,机制不同。RNA-seq 分析显示 UTX 缺失将 RGC 转录组学逆转到发育样状态,Klf4 是周围神经系统DRG神经元和视网膜RGCs中UTX-H3K27me3 信号转导的直接下游靶标。这些发现不仅揭示了UTX和JMJD3在神经再生中的不同作用及其潜在机制,而且还确定了UTX介导的组蛋白去甲基化信号转导是支持CNS神经再生的新型表观遗传靶标(Advanced Science,2025)。
与此同时,刘长梅研究组与北京同仁医院王宁利教授合作,揭示了H3K27me3下游的一个靶标转录因子LHX2与组蛋白修饰协同作用,促进RGCs存活和轴突再生的机制。研究表明,LHX2通过激活再生相关基因的表达,为青光眼等神经退行性疾病的治疗提供了新的策略(Cell Reports Medicine,2024)。这些研究提示,通过调控EZH2、UTX或LHX2的表达,可以将成体神经元的转录组图谱逆转至更具神经生长能力的年轻状态,从而促进神经再生。
2. 组蛋白修饰在神经元发育中的调控作用
组蛋白修饰不仅在神经再生中发挥重要作用,还深刻影响神经发育过程。刘长梅课题组研究发现,组蛋白甲基转移酶PRC2(多梳抑制复合物2)的核心亚基EED在胚胎期皮层发育和海马齿状回发育中具有重要功能。EED通过催化H3K27me3修饰,调控Gli3、Gli1、Cdkn2a、Sox11等关键基因的表达,从而影响神经干/祖细胞(NSPCs)的增殖和分化(Stem Cell Reports,2019;Stem Cell Reports,2022)。H3K27me3修饰的异常导致神经干细胞分化受阻,进而影响皮质神经发生和海马齿状回的正常发育。
此外,研究组还首次揭示了染色质重塑SWI/SNF复合体组分ARID1A通过介导特定位点组蛋白修饰,调控海马区神经干/祖细胞向神经元谱系转变的功能(Cell Death and Differentiation,2023)。ARID1A缺失会导致小鼠海马突触传递和树突形态缺陷引起的认知障碍,以及人类兴奋性神经元的树突分支和电生理活动异常。值得注意的是,补充表观遗传代谢物乙酸盐可以改善ARID1A缺失引起的形态学和电生理学缺陷,提示乙酸盐可能成为Coffin-Siris综合征(CSS)的潜在治疗干预措施(EMBO Molecular Medicine,2022)。
小脑在运动协调、平衡控制以及感觉运动学习等方面发挥着核心作用。研究发现,组蛋白H3K27me3修饰异常会导致小脑发育缺陷,进而引发一系列运动和认知障碍。EED作为PRC2的核心亚基,通过催化H3K27me3修饰,与非编码RNA H19形成负反馈调节环路,精细调控小脑颗粒细胞祖细胞的增殖、分化和凋亡过程(Advanced Science,2025)。这一发现为理解小脑发育缺陷及相关疾病的发病机制提供了重要依据。
3.组蛋白修饰研究的科学意义与应用前景
上述关于组蛋白修饰的一系列研究成果,具有重要的科学意义和应用价值。在基础研究领域,这些成果极大地拓展了我们对大脑发育和神经发育以及神经再生障碍疾病发病机制的认知,让我们对基因表达调控的复杂性和精细性有了更为深刻的理解。在临床应用方面,这些发现为开发新型诊断和治疗方法提供了潜在的靶点。例如,针对特定组蛋白修饰异常设计的干预措施,有望成为治疗自闭症、小脑发育不全等神经发育疾病的创新干预手段。
综上所述,随着对组蛋白修饰研究的持续深入,我们有理由相信,未来能够进一步揭开其在大脑发育和疾病中的神秘面纱,为改善人类健康带来更多的希望。该系列研究得到了国家重点研发计划项目、中国科学院先导项目、中国科学院青年创新促进会、国家自然基金项目、中国科学院动物研究所自主部署项目以及器官再生与智造国家重点实验室开放项目等基金的资助。

(中国科学院动物研究所刘长梅团队,北京基因组研究所杨运桂团队,中国科学院动物研究所/北京干细胞与再生医学研究院滕兆乾团队和南京医科大学李荣凤团队共同完成)
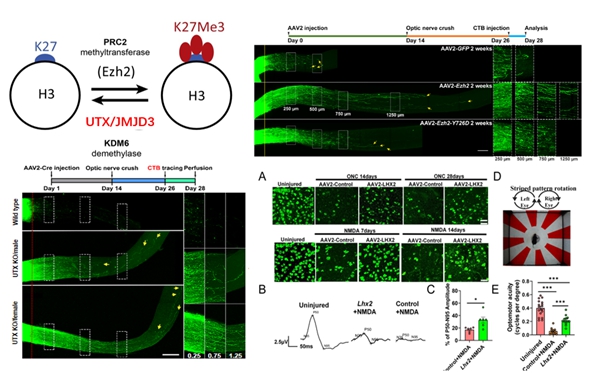
(J Clin Invest,2024;Cell Rep Med,2024;Advanced Science,2025)
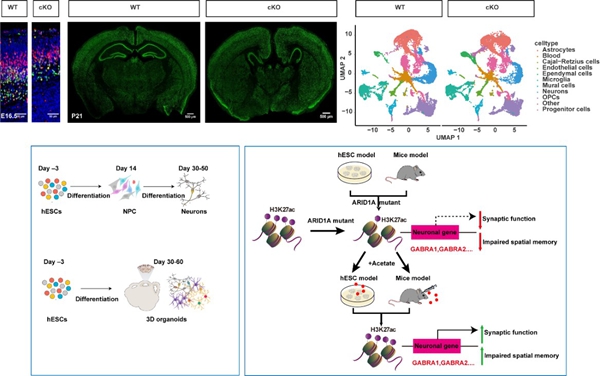
(EMBO Mol Med,2022;Cell Death Differ,2023)
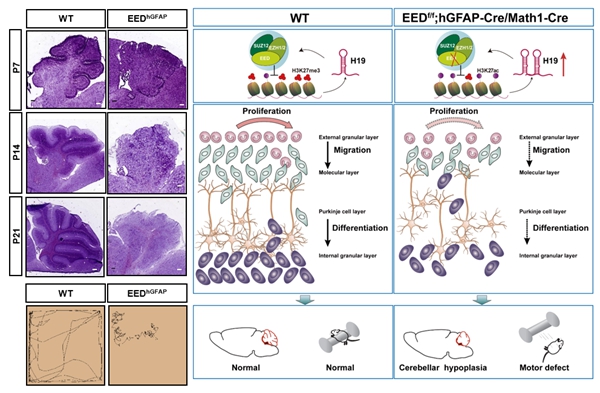
(Advanced Science,2025)

全球约三分之一陆地生物多样性热点区域以及60%的陆栖脊椎动物分布在跨境地带,这些区域同时也面临生物入侵、气候变化、生境干扰等诸多全球变化挑战。自然保护地是维系本土物种原生性和抵御外来物种入侵的重要载体...
虫媒植物病毒的感染涉及病毒、媒介昆虫和植物寄主之间的复杂互动。大约80%的植物病毒依赖昆虫传播,通常在植物体内而非昆虫媒介中引发严重症状。
为了研究衰老对男性生殖的影响,中国科学院院动物研究所/北京干细胞与再生医学研究院郭靖涛研究组此前系统研究并揭示了年轻(20多岁)和年老(60岁以上)男性睾丸的分子和转录差异,并发现衰老和肥胖叠加会显著加...

