焦建伟研究组发现组蛋白变体H2A.z调控大脑发育的机制
大脑是一个高度复杂、精密有序的结构,它由多样的神经元以及神经胶质细胞等构成复杂的神经元网络,从而调控语音、情绪、学习、记忆和思维活动等功能。胚胎大脑是研究脑发育机理以及探究某些神经发育疾病的重要模式系统。在胚胎大脑发育过程中,神经元发生(neurogenesis)始于脑室区(ventricular zone,VZ)和脑室下区(subventricular zone,SVZ)的神经前体细胞,通过一定的迁移模式到达正确位点,最终组成高度精细、复杂的神经回路。胚胎大脑发育异常可导致各种神经发育疾病,比如精神分裂症(Schizophrenia)、自闭症(Autism)、癫痫(Epilepsy)等。一直以来,围绕神经前体细胞的增殖与分化、神经元的迁移、突触的重塑等的机制研究成为了神经科学领域备受关注的研究热点。
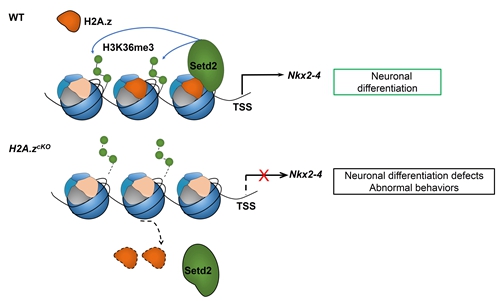
组蛋白变异体参与染色体组装和调控。与常规组蛋白形成的染色质结构相比,组蛋白变异体可以形成一些独特的染色质结构,进而在基因表达和细胞命运决定等过程中发挥着重要作用。组蛋白变体H2A.z是常规组蛋白H2A的重要变体之一。近年来的研究发现H2A.z广泛参与转录调节、基因组稳定性;并且在细胞增殖、分化等过程中发挥至关重要的作用。然而,H2A.z在神经前体细胞的增殖与分化中的作用研究较少。因此,探索这一过程中将有助于深入了解胚胎大脑的发育。
首先,本项研究通过体内胚胎电转的手段,以及建立H2A.z大脑特异性敲除小鼠(cKO)模型,观察H2A.z缺陷对于神经前体细胞增殖和分化以及神经元形态的影响。研究发现H2A.z缺陷导致神经前体细胞过度增殖并抑制其分化;H2A.z缺陷抑制神经元树突的发育。其次,通过RNA-seq分析发现,在cKO的小鼠胚胎大脑组织中,Nkx2-4的表达量显著下调,进一步通过H2A.z ChIP-seq和H3K36me3 ChIP-seq分析表明,H2A.z的缺失影响了Nkx2-4启动子的H3K36me3结合。除此之外,我们发现H2A.z能招募H3K36三甲基转移酶Setd2,加强了Nkx2-4启动子的活性,从而促进Nkx2-4的转录。重要的是,过表达H2A.z及NKX2-4能够回救H2A.z缺陷造成的神经发生的异常。最后,行为学分析表明H2A.z在大脑功能发挥方面扮演着重要角色,H2A.z缺陷导致记忆下降及社交障碍。因此,我们的研究不仅揭示了组蛋白变体H2A.z对胚胎大脑发育的影响机制,而且还证实了其在大脑功能发挥方面也发挥重要作用,进一步推动我们了解大脑发育和功能异常的表观遗传调控机理。
这项研究工作以“Brain-specific deletion of histone variant H2A.z results in cortical neurogenesis defects and neurodevelopmental disorder”为题于2017年12月27日在国际重要杂志Nucleic Acids Research在线发表。本文第一作者为博士研究生沈天津,通讯作者为焦建伟研究员。该课题得到了国家自然科学基金重点项目及创新群体项目、国家重点基础研究计划、中国科学院王宽诚教育基金、中国科学院战略性先导科技专项的资助。(文章链接)
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

