中科院动物研究所开发新型基因组编辑工具—CRISPR/Cas12b
近年,CRISPR基因编辑技术及其相关应用成为生命科学领域备受关注的热点研究方向。基于这种技术,科学家们可高效、快速、便捷地对感兴趣的基因进行编辑,从而在基础科研、农业和医学的发展中具有重要应用。
目前CRISPR系统中有两类效应蛋白家族(Cas9和Cas12a/Cpf1)被成功改造成哺乳动物及其它模式生物的基因组编辑工具,包括首先由Doudna JA、Charpentier E和Zhang F等实验室在2012年和2013年报道的Cas9系统。她/他们利用Cas9系统有效地实现了哺乳动物基因组的编辑,并带动了基因编辑领域的迅猛发展,将基因编辑技术成功拓展到基因转录表达调控、表观遗传修饰、全基因组功能筛选、碱基编辑、基因组成像和细胞谱系追踪等多种生物学应用。以及Zhang F等人在2015年发现并改造的Cas12a(又称为Cpf1)系统,也能实现哺乳动物等多个物种的基因组编辑。与此同时,科学家们也在一直致力于新的基因编辑系统的建立,尤其是更适合基因治疗使用的工具系统。
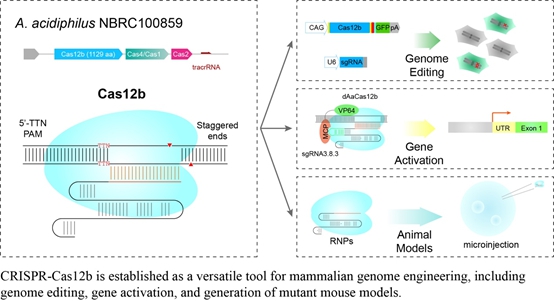
近年来鉴定出的一个新的CRISPR系统,Cas12b(又称为C2c1),因其嗜高温的特性没能应用于基因组编辑。动物研究所研究团队通过系统挖掘,成功地鉴定出若干能在人体生理温度工作的Cas12b/C2c1酶。经过系统改造,两种Cas12b/C2c1酶被成功开发成为哺乳动物基因组编辑工具,能够编辑人类细胞基因组并应用于制备动物疾病模型。这些Cas12b/C2c1是双RNA导向的核酸酶,识别5'-TTN的PAM序列,切割DNA后产生粘性末端。进一步改造可以将这些Cas12b/C2c1酶用于基因组的激活等延展应用。与之前报道的Cas9和Cas12a/Cpf1酶相比,Cas12b/C2c1酶有若干优势与特点:(1)Cas12b/C2c1比应用最为广泛的SpCas9和Cas12a/Cpf1要更小,因此更容易用于需要在体递送的基因治疗。(2)Cas12b/C2c1能够在宽广的温度范围和pH范围保持高的酶活性,有望适用于具有不同生理温度的多个物种。同时与SpCas9相比,Cas12b/C2c1核糖核酸酶(RNP)在人血浆中更稳定。(3)Cas12b/C2c1很难耐受向导RNA与靶DNA之间的碱基错配,因此比SpCas9和Cas12a/Cpf1的脱靶效应更小,这意味着它在进行基因组编辑时更加安全。针对这项新技术,该研究团队已于一年前提交了专利申请,并正在开发这项技术在基因治疗中的应用。
相关成果于2018年11月27日在国际学术期刊Cell Discovery发表。该研究工作由中国科学院动物研究所和中国科学院干细胞与再生医学创新研究院完成。中国科学院动物研究所李伟研究员为论文的通讯作者;博士生滕飞、崔彤彤为共同第一作者。该研究受到中科院战略科技先导专项及科技部、基金委等项目的资助。(文章链接)
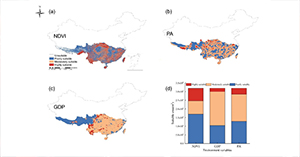
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
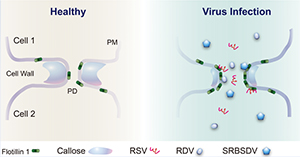
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

