动物所合作揭示ZKSCAN3延缓人干细胞衰老的表观遗传机制
ZKSCAN3是具有SCAN结构域的锌指蛋白家族成员之一,曾被报道作为转录调节因子抑制自噬相关基因的表达。然而目前国际上关于ZKSCAN3的研究主要基于肿瘤细胞系及模式动物,其在正常人类干细胞等二倍体细胞中的生物学功能尚不明确。
2020年5月19日,中国科学院动物研究所曲静研究组、刘光慧研究组及中国科学院北京基因组研究所张维绮研究组合作,在Nucleic Acids Research杂志在线发表题为“ZKSCAN3 counteracts cellular senescence by stabilizing heterochromatin”的研究论文。该研究首次报道ZKSCAN3通过自噬非依赖性的方式延缓人干细胞衰老。机制方面,ZKSCAN3能通过稳固细胞核膜蛋白与异染色质的相互作用,从而增强基因组稳定性并抑制重复元件表达。
在该项研究中,研究人员首先发现ZKSCAN3在人类早衰症间充质干细胞、复制性衰老间充质干细胞,以及老年个体分离的原代间充质干细胞中均呈现出下调表达,暗示着ZKSCAN3与衰老调控的潜在联系。进而利用CRISPR/Cas9介导的基因编辑技术和干细胞定向诱导分化技术,研究人员首次获得了靶向敲除ZKSCAN3的人胚胎干细胞和间充质干细胞。尽管ZKSCAN3的缺失不影响人胚胎干细胞的自我更新和分化,但ZKSCAN3敲除的人间充质干细胞则表现为加速衰老的表型。
研究人员进一步通过整合相互作用蛋白质谱(Co-IP/MS)、染色质免疫共沉淀测序(ChIP-seq)、染色质可及性测序(ATAC-seq)、DNA腺嘌呤甲基转移酶互作测序(DamID-seq)及RNA测序(RNA-seq)等多层次组学分析,发现ZKSCAN3能与核膜蛋白(Lamin B1、LBR)和异染色质蛋白(KAP1、HP1a)相互作用。ZKSCAN3的缺失导致人间充质干细胞中核膜蛋白同基因组相互作用减弱、异染色质丢失、基因组重复元件(LINE, SINE, Satellite family)转录水平升高,最终诱发人间充质干细胞衰老。值得注意的是,过表达ZKSCAN3或通过CRISPRa系统激活内源ZKSCAN3表达均可延缓人间充质干细胞衰老。
该研究首次揭示了ZKSCAN3作为表观调控因子,调控人干细胞稳态并抑制其衰老的新功能与新机制。这一发现拓展了人们对锌指蛋白家族新功能的认知,加深了对衰老表观遗传机制的理解,并为延缓干细胞衰老、防治衰老相关疾病提供了重要的线索和思路。
该研究由中国科学院动物研究所、中国科学院北京基因组研究所、中国科学院干细胞与再生医学创新研究院、首都医科大学宣武医院、国家生物信息中心等机构合作完成。中国科学院动物研究所曲静研究员、刘光慧研究员、中国科学院北京基因组研究所张维绮研究员和中国科学院动物研究所王思副研究员为文章的共同通讯作者。中国科学院动物研究所博士研究生胡慧芳、硕士研究生季乾昭、研究员宋默识为并列第一作者。该工作得到中国科学院北京基因组研究所任捷研究员的合作与支持,获国家科技部、国家自然科学基金委、中国科学院和北京市等项目资助。
文章链接:https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkaa425/5840577
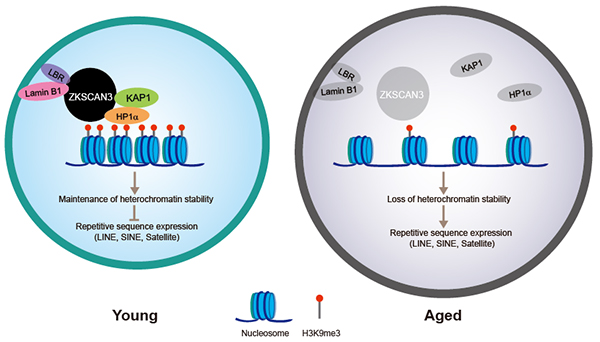
图:ZKSCAN3维持异染色质稳定性并延缓人干细胞衰老
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
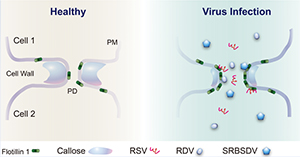
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

