中科院动物研究所合作开发结晶样视网膜变性病的基因治疗
结晶样视网膜变性(Bietti crystalline dystrophy, BCD)是一类会对视力健康造成严重危害的单基因遗传病,以患者眼底的大量黄白色闪亮结晶沉积为代表性特征。它的另一个显著特征是,相对于其他人群,BCD在东亚人群中具有显著增高的发病率。据估计,中国人群中BCD的发病率约为1/24000,占全部视网膜色素变性患者的1/6至1/10。大多数BCD患者于20-40岁发病,出现夜盲和视力下降等症状,在50-60岁发展为法定盲人。
虽然是一类危害严重的致盲性遗传眼病,但与一些西方媒体高度关注的“明星遗传病”相比,针对BCD的基础和临床研究都较为匮乏。迄今BCD仍然缺乏有效的动物模型,导致一方面无法进一步了解BCD病程的影响因素;另一方面也无法验证潜在的治疗药物。在意大利医生G.B. Bietti首次临床观察到并为这种疾病命名的八十年之后,BCD依然无药可治。
CYP4V2是人体内的ω-氢基化酶基因,在多种代谢通路中发挥作用。遗传自父方和母方的CYP4V2基因同时发生突变,导致了BCD的发病。相对于正常水平而言,BCD患者体内的脂类水平有着显著异常。通过敲除小鼠中包含整个Cyp4v3(CYP4V2的小鼠同源基因)的完整基因座,中科院动物所研究团队成功构建了Cyp4v3完全缺失的小鼠模型。进一步研究发现,高脂肪饲料喂养的Cyp4v3缺失小鼠模型,展现出眼底结晶和视力功能下降的双重BCD疾病表型。作为六大营养物质之一,脂肪在日常饮食中无法避免。以上的研究结果表明,过高的脂类水平不仅是BCD疾病的异常表征,还是能加速BCD疾病进程的危险因素。这提示了控制日常脂肪摄入,可能是改善BCD疾病护理、延缓疾病进程的重要手段。
基因治疗(Gene Therapy)是将外源基因导入细胞,纠正或补偿因基因缺陷或基因表达异常引起的疾病的新型治疗手段,在对遗传性疾病的治疗上具有重大潜力。动物所研究团队通过与北京协和医院合作,将腺相关病毒 (Adenovirus associated virus, AAV)包装的人CYP4V2基因注射到高脂肪饲喂的Cyp4v3敲除小鼠模型眼底,进一步验证基因治疗对BCD的适用性。研究发现,经过基因治疗的小鼠眼底厚度显著增加,视觉功能(眼底的电生理反应水平)也得到改善。这些结果首次在活体动物模型中展现了基因治疗对于BCD治疗的有效性,为BCD患者带来了希望的曙光。
相关成果于2020年 6月1日在国际学术期刊Gene Therapy发表[1]。该研究工作由中国科学院动物研究所、中国科学院干细胞与再生医学创新研究院和北京协和医院合作完成。中国科学院动物研究所李伟研究员和北京协和医院睢瑞芳教授为论文的通讯作者;曲彬、吴世靖、焦贯怡、邹绚、李治琨、郭璐为共同第一作者。该研究受到科技部、基金委及中科院战略科技先导专项等项目的资助。
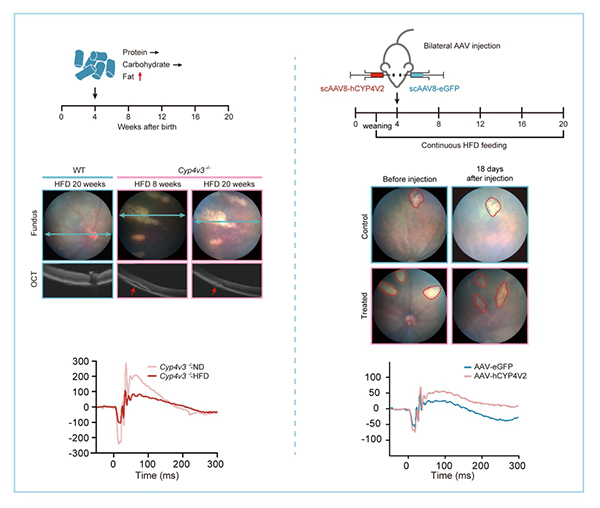
图1 高脂饮食加速BCD疾病进程,基因治疗改善模型鼠视觉功能
论文链接:https://www.nature.com/articles/s41434-020-0159-3
1. Qu B, Wu S, Jiao G, Zou X, Li Z, Guo L et al. Treating bietti crystalline dystrophy in a high-fat diet-exacerbated murine model using gene therapy. Gene Therapy. 2020. https://doi.org/10.1038/s41434-020-0159-3
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

