王德华研究组揭示了“甲状腺—肠道菌群”轴对恒温动物产热和体温的调节作用
恒温动物维持高而恒定的体温对于其生存至关重要,而体温的维持具有较高的能量代价,体温调节是一个经典的生理学问题。甲状腺激素是由甲状腺细胞分泌,包括甲状腺素(T4)和三碘甲状腺原氨素(T3),T4经过碘甲腺原氨酸脱碘酶II(DIO2)脱碘后生成T3而起作用,甲状腺激素能够提高能量代谢、促进生长发育并提高神经系统的兴奋性。在人类,甲状腺激素代谢紊乱会发展为甲亢(甲状腺机能亢进)或甲减(甲状腺机能减弱)疾病,其中遗传、药物、长期应激等是形成甲亢的主要因素,发病率高达10%左右,而且难以治疗。关于甲状腺激素调节代谢产热的作用机制,已有研究认为主要通过中枢调控通路或外周直接作用于器官调节细胞的代谢过程,前期研究已发现肠道微生物能够调节宿主动物的能量代谢。一个重要的问题是,甲状腺功能紊乱是否与肠道菌群失衡有关从而导致能量代谢和产热的变化?对这一问题的解释,不仅能够揭示恒温动物的体温调节机制,而且对于认识甲状腺疾病的成因和治疗方法提供科学依据。
2021年3月17日,中国科学院动物研究所王德华研究团队在国际期刊Microbial Biotechnology上发表题为“Caecal microbial transplantation attenuates hyperthyroid-induced thermogenesis in Mongolian gerbils”的研究论文,发现了高甲状腺激素(甲亢)引起的代谢升高是由于肠道菌群紊乱导致的,阐明了“甲状腺—肠道菌群”轴对恒温动物产热和体温的调节功能。
这是该研究组自发现肠道菌群介导聚群行为产热的能量节省机制(Microbiome, 2018),食粪行为通过维持微生物稳态调节宿主能量平衡、神经功能和认知行为(The ISME Journal, 2020),进一步发现肠道菌群赋予恒温动物对周期性温度波动的代谢可塑性(mSystems, 2020),以及“交感神经—肠道菌群”轴调控冷适应性产热的机制(The ISME Journal, 2019)等成果以来,在野生动物与其肠道微生物相互作用调控能量代谢和产热适应研究领域又一新的发现。
在这项工作中,研究人员利用长爪沙鼠(Meriones unguiculatus)T4处理4周诱导甲亢模型,利用甲巯基咪唑药物处理阻断甲状腺激素的合成诱导甲减模型。研究发现甲亢动物表现出较高的代谢率和体温,甲减动物代谢率明显降低;无论甲亢还是甲减动物,肠道菌群结构紊乱,甲亢动物肠道中螺旋杆菌属(Helicobacter)、理研菌属(Rikenella)相对比例升高,而有益菌如丁酸弧菌(Butyricimonas)和副拟杆菌(Parabacteroides)相对比例较低,相关分析显示这些菌属与甲状腺素代谢密切相关;甲亢动物肠道菌群的代谢产物短链脂肪酸含量和总胆汁酸含量明显降低。通过对甲亢动物移植正常动物来源的肠道菌群,能够促进肝脏中碘甲腺原氨酸脱碘酶II(DIO2)表达,提高T3和T4的代谢周转速率,促进甲亢动物代谢率和体温的恢复。
该研究阐明了“甲状腺—肠道菌群”轴对恒温动物产热和体温的调节作用,揭示了肠道菌群与宿主内分泌系统相互作用对体温调节的重要生理意义,并且为甲亢疾病的治疗提供可能的有效干预措施。中国科学院动物研究所农业虫害鼠害综合治理研究国家重点实验室动物生理生态学研究组博士研究生Saeid Khakisahneh和副研究员张学英为共同第一作者,王德华研究员和张学英为共同通讯作者。该研究主要得到了国家自然科学基金项目(31770440、31772461和32090020)的资助。
文章链接:https://doi.org/10.1111/1751-7915.13793
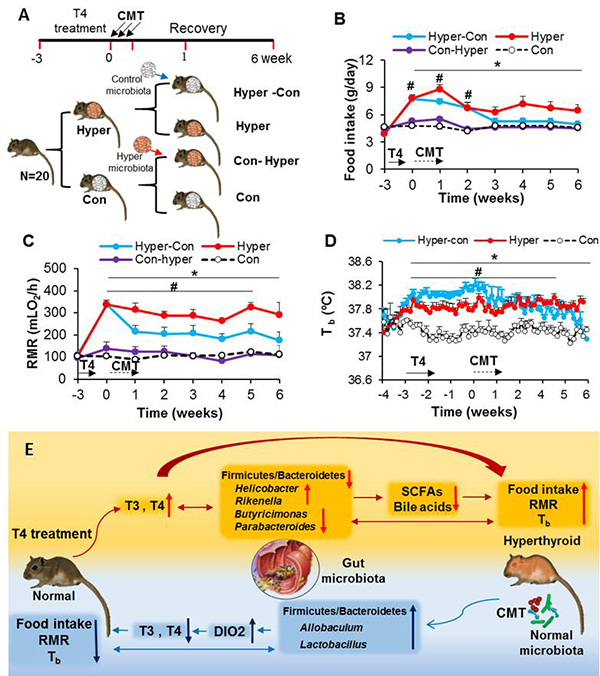
图 “甲状腺—肠道菌群”轴对长爪沙鼠代谢产热和体温调节的作用
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

