焦建伟研究组揭示脑血管内皮细胞调控神经前体细胞命运决定的新机制
在哺乳动物新皮质发育过程中,神经前体细胞逐渐改变其特征和形态,依次形成神经元,星形胶质细胞和少突胶质细胞。顺序性分化是一种进化机制,神经元和胶质细胞的生成时间受到严格的调控。前期研究表明,神经系统的内外因素影响神经前体细胞神经源性向胶质源性转变。一个潜在的机制是神经前体细胞的内源因素,如神经前体细胞表面受体和转录因子。另一个潜在的机制是外源信号,如神经元分泌的因子。然而,除了神经系统以外,其他系统如血管是否影响神经前体细胞神经源性向胶质源性转变的机制仍然需要更加全面的研究。在神经前体细胞增殖和依次分化产生神经元和星形胶质细胞的同时,中枢神经系统变得血管化。由高特异性内皮细胞组成的脑血管系统作为神经前体细胞微环境的重要调节者,参与氧气和营养物质运输,监测细胞代谢等以维持正常的脑功能。然而,发育中的脑血管在调控神经前体细胞神经源性向胶质源性转变的机制尚不清楚。
2022年4月30日,中国科学院动物研究所焦建伟研究组在Advanced Science杂志上发表了题为Endothelial cells mediated by UCP2 control the neurogenic-to-astrogenic neural stem cells fate switch during brain development 的研究论文。这项工作揭示了脑血管内皮细胞在发育中的新皮质中调节神经前体细胞神经源性向胶质源性转变的作用机制。
线粒体是血管内皮细胞的信号细胞器,研究人员关注到内皮细胞中线粒体内膜分子UCP2。在这项研究中,他们发现随着发育的进行UCP2在血管内皮细胞中的表达水平逐渐升高。内皮细胞UCP2基因敲除导致内皮细胞代谢水平改变,减少血管直径。研究人员进一步发现,内皮细胞的紊乱导致神经前体细胞神经发生向胶质发生的过渡时间提前,最终导致神经元数目减少,星形胶质细胞数目增多。并且内皮细胞UCP2基因敲除导致小鼠出生后星形胶质细胞数目持续增加。研究人员进一步通过对脑血管内皮细胞进行RNA测序,发现糜蛋白酶 CMA1表达增强导致血管紧张素II (Ang II)分泌到内皮细胞外。内皮细胞来源的Ang II结合到神经前体受体(血管紧张素II 1a型受体,Agtr1a)进而激活JAK-STAT通路启动胶质发生。此外,抑制内皮细胞UCP2表达促进人神经前体细胞向星形胶质细胞分化,减少人神经前体细胞向神经元的分化。
综上所述,这项研究揭示了大脑发育中血管分泌重要的调控因子影响神经前体细胞顺序分化的新机制,为神经细胞发生向星形胶质细胞发生过渡时间的精确性调控提供了更加全面的理解,并且可以帮助我们更全面的认识胚胎期大脑皮层发育的复杂性,将更好理解大脑发育的进程和基本规律,为神经系统疾病的诊断提供理论基础。
中国科学院动物研究所焦建伟研究员为该论文的通讯作者,中国科学技术大学与中国科学院动物研究所联合培养博士研究生王稳稳和中国科学院动物研究所博士后苏立波为该论文的共同第一作者。该研究获得了国家科技部、国家自然科学基金委、中国科学院先导等项目的资助。
原文链接:http://doi.org/10.1002/advs.202105208
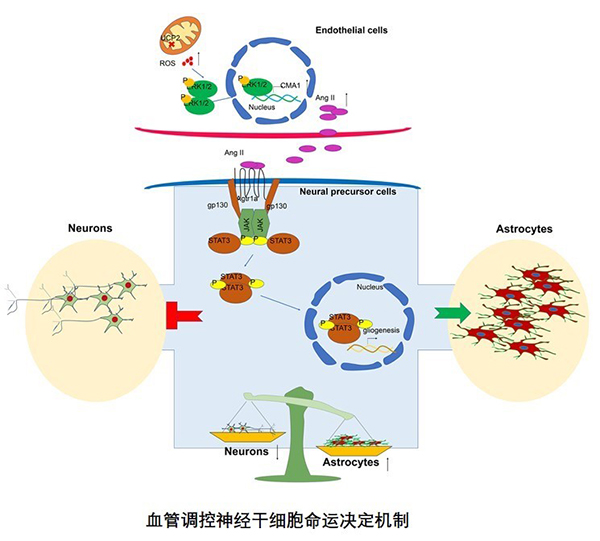
血管调控神经干细胞命运决定机制
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

