焦建伟研究组揭示脑发育过程中小胶质细胞代谢调控星形胶质发生的机制
在早期脑发育过程中,需要多个系统协同工作以确保大脑皮层的有序组装,各个系统如何实现精确的自我调节和相互通信是有待解决的重要科学问题。小胶质细胞作为中枢神经系统的固有免疫细胞,为维持自稳态及协调其他系统的发育需要经历一系列的重编程。然而,目前尚不清楚小胶质细胞是否在神经发育的不同阶段进行代谢重编程,以满足大脑有序发育的需求。星形胶质细胞是中枢神经系统的另一类重要胶质细胞,起源于神经元和少突胶质细胞的共同神经祖细胞。在神经炎症的情况下小胶质细胞与星形胶质细胞之间的相互交流更为明显。先前的研究表明,小胶质细胞发育异常及星形胶质发生紊乱均有可能是焦虑样行为的成因。因此有必要探讨胶质发生与脑疾病的关联性。
2023年12月14日,中国科学院动物研究所焦建伟研究组在Developmental Cell杂志上发表了题为BACH1 changes microglial metabolism and affects astrogenesis during mouse brain development的研究论文。这项工作揭示了小胶质细胞代谢转变在发育中的新皮层中调控星形胶质发生的机制。
Bach1的主要功能包括调节线粒体代谢、参与糖酵解、调控血红素稳态等。近年来,相关研究多数聚焦在Bach1参与氧化磷酸化和糖酵解代谢重编程的机制探究。糖酵解产生的乳酸被认为是组蛋白乳酸化的底物,组蛋白乳酸化修饰已显示出激活基因转录的有趣功能。作为糖酵解调控的重要调控因子,探索Bach1在发育中的小胶质细胞代谢重编程中的功能尤其令人兴奋。
研究团队首先发现在脑发育过程中,缺失Bach1的小胶质细胞表现出稳态失衡及星形胶质发育紊乱。进一步通过慢病毒与腺相关病毒敲降策略实现体内和体外小胶质细胞源性Bach1的特异性缺失,观察到与Bach1cKO-Cx3cr1鼠类似的表型。在机制方面,通过免疫共沉淀实验发现小胶质细胞源性的Bach1限制糖酵解过程中两个关键限速酶HK2和GAPDH的转录来减少乳酸的产生。进一步通过RNA-seq聚焦到Bach1的潜在下游靶点Lrrc15。筛选常见的乳酸化修饰位点(H4K12la,H4K5la和H3K18la)后发现,小胶质细胞Bach1缺失引起的乳酸减少导致Lrrc15启动子处H4K12la富集减少,从而抑制转录。此外,研究发现LRRC15与星形胶质前体细胞的受体(CD248)之间存在直接的相互作用,进而激活JAK/STAT3通路调控星形胶质发生,并诱导了焦虑样行为,如探索能力受损和社交障碍。
综上所述,该研究团队阐明了小胶质细胞代谢重编程的重要调控因子影响星形胶质发生的机制,进而导致脑发育疾病。该研究阐述了小胶质细胞-星形胶质细胞通讯机制,为发育相关疾病的诊断和治疗奠定理论基础。
中国科学院动物研究所焦建伟研究员为该论文的通讯作者,中国科学院动物研究所博士研究生王岩岩和中国科学技术大学与中国科学院动物研究所联合培养博士研究生王稳稳为该论文的共同第一作者。该研究获得国家科技部、国家自然科学基金委的资助。
文章链接:https://doi.org/10.1016/j.devcel.2023.11.018
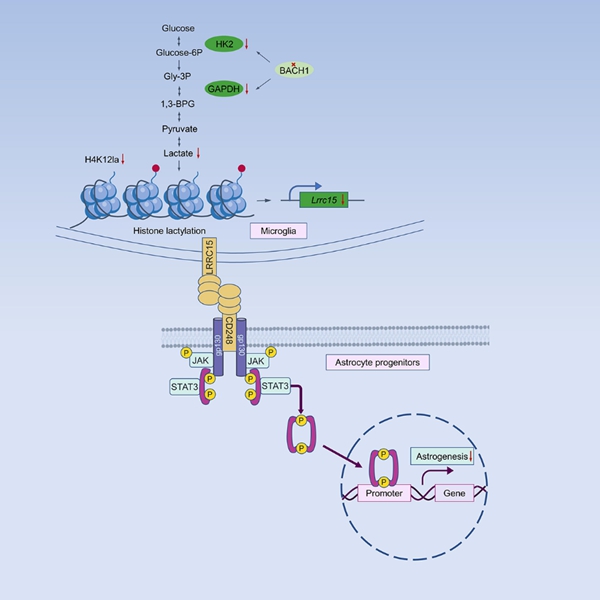
Bach1改变小胶质细胞代谢进而影响星形胶质发生
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

