李卫团队揭示蛋白质泛素化与SUMO化修饰交互作用在减数分裂中的新机制
蛋白质翻译后修饰(Post-translational modification,PTM)是生物体生命活动的重要调控方式,蛋白质的泛素化(Ubiquitylation)与SUMO化修饰(small ubiquitin-related modifier;SUMOylation)是当前蛋白质翻译后修饰研究领域的热点。研究发现蛋白质的泛素化与SUMO化修饰之间存在交互作用(Ubiquitylation-SUMOylation Crosstalk),其中SUMO靶向泛素连接酶(SUMO-targeted ubiquitin ligases;STUbLs)是一种重要的泛素化-SUMO化交互调控因子。蛋白质泛素化与SUMO化修饰之间的交互作用极大的丰富了两种翻译后修饰功能的复杂程度,SUMO靶向泛素连接酶在基因调控、维持基因组稳定性、胚胎发育、癌症等多种生理过程中均发挥重要作用,然而蛋白质的泛素化与SUMO化修饰交互作用在减数分裂过程发挥何种功能,SUMO靶向泛素连接酶如何参与减数分裂调控目前还知之甚少。
为了研究蛋白质泛素化与SUMO化修饰交互作用在减数分裂中的作用机制,研究人员首先在酵母减数分裂过程中对SUMO靶向泛素连接酶进行功能筛选,发现复合物Slx5p-Slx8p任一蛋白的缺失均会影响减数分裂的正常进行。进一步研究发现敲除SLX8影响减数分裂同源染色体间联会复合体组分蛋白的降解,而未能有效降解的联会复合体蛋白影响同源染色体正确分离。Slx8p的泛素连接酶活性以及SUMO识别结构域对其在减数分裂的功能至关重要,预示Slx8p介导的蛋白质泛素化与SUMO化修饰交互作用在减数分裂同源染色体的正确分离过程中发挥重要作用。为了进一步验证该结论,研究人员在SLX8敲除菌株中表达融合的泛素-SUMO蛋白,将泛素化与SUMO化修饰人为联系起来,结果发现泛素-SUMO融合蛋白可以部分拯救SLX8敲除造成的减数分裂异常。为了进一步明确Slx5p-Slx8p在减数分裂过程中的关键作用底物,研究人员体外重构了Slx5p-Slx8p泛素化体系,发现Slx5p-Slx8p可以在SUMO化修饰的联会复合体蛋白Zip1p以及Ecm11p上直接催化泛素化修饰。在SLX8敲除菌株减数分裂过程中利用AID系统诱导Ecm11p蛋白的降解可以部分拯救其减数分裂异常。因此,SUMO靶向泛素连接酶Slx5p-Slx8p可以在SUMO化修饰的联会复合体蛋白Ecm11p上催化泛素化并介导其降解,进而调控同源染色体的正确分离。
以上工作首次阐明SUMO靶向泛素连接酶Slx5p-Slx8p在减数分裂过程中介导蛋白质泛素化与SUMO化修饰交互作用,促进SUMO化修饰的联会复合体蛋白的降解进而调控同源染色体的正确分离。为人们进一步理解蛋白质翻译后修饰的复杂调控提供了新思路。相关结果于2020年1月1日以题为“Slx5p-Slx8p promotes accurate chromosome segregation by mediating the degradation of synaptonemal complex components during meiosis”发表在Advanced Science (https://doi.org/10.1002/advs.201900739)。中国科学院动物研究所刘超、赵海超、肖赛为共同第一作者,动物所李卫研究员和北京医院老年医学研究所李国平副研究员为论文共同通讯作者。该项目得到了中国医学科学院创新工程、国家自然基金委以及中国科学院青年促进会的支持。
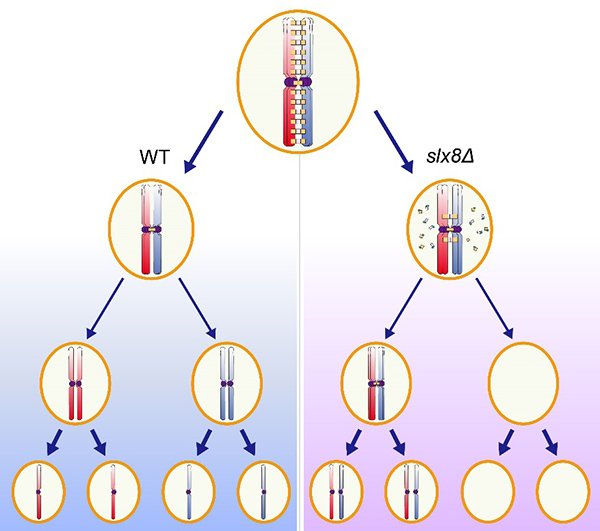
Slx5p-Slx8p调控联会复合体蛋白的降解进而促进同源染色体的正确分离
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。

植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

