于乐谦/王红梅研究员合作研发 3D 子宫胚胎植入模拟芯片,破解人类胚胎植入研究难题
近日,国际顶刊《Cell》发表一项改写辅助生殖格局的重磅研究——中国科学院动物研究所于乐谦、王红梅研究员联合美国德克萨斯大学西南医学中心吴军教授、中国农业大学魏育蕾教授,首都医科大学附属北京妇产医院杨晓葵教授联合团队。成功研发出基于微流控芯片的3D胚胎植入模型(3D子宫模拟芯片)(图1)。
这项技术不仅首次在实验室完整复刻人类胚胎着床过程,更带来了可直接惠及患者的临床突破。研究表明,中国的不孕症人群规模已超过 4000万,其中在接受辅助生殖技术(ART)治疗的患者中,约有 10% 的个体在经历 3 次或更多次胚胎移植后仍无法实现临床妊娠,从而陷入反复种植失败(RIF)的困境 ,这是目前辅助生殖领域面临的重大挑战。而该技术的开发,则可能明确RIF发生的核心病因、筛选个性化有效药物、简化检测流程,让无数受困家庭告别“盲目试孕”,迎来精准治疗的新希望。
一、患者最关心:这项技术能帮我解决什么问题?
对于反复经历胚胎种植失败的患者来说,“为何怀不上”“该怎么治”是最迫切的疑问。这项研究直击痛点,给出了应对方案:
1.体外模拟:探索找到“怀不上”的潜在原因
过去,RIF病因诊断如同“大海捞针”,胚胎、子宫内膜、免疫系统等多个环节都可能出问题。而通过3D子宫模拟芯片,科研团队发现:RIF患者的子宫内膜细胞存在显著异常——凋亡细胞增多、增殖能力下降、DNA损伤累积,就像“孕育种子的土壤”变得贫瘠,即便移植优质胚胎也难以着床。更关键的是,在芯片模型中,RIF 患者来源的子宫内膜组织囊胚植入率仅为健康人群的 60%,且植入后胚胎形成羊膜腔、卵黄囊的比例不足健康组的 1/3,与临床中患者 “移植成功但胚胎停育” 的表现完全吻合。这意味着未来患者只需提供少量子宫内膜样本,就能通过模型明确自身是否存在子宫内膜功能异常,告别“病因不明”的困扰。
2. 快速筛选:精准确定“最适合”的个性化药物
传统RIF治疗多为“广谱尝试”,效果参差不齐。而3D子宫模拟芯片搭建了高效药物筛选平台,科研团队已对1119种美国FDA批准的药物完成测试。个性化药物筛选包括两轮实验:首先在子宫内膜类器官(endometrioid)中筛选提高活力的药物,然后在3D子宫模拟芯片中测试用药后对胚胎植入的效果。针对不同患者的具体异常,筛选结果更具个性化:例如 RIF-60 患者存在 “雌激素受体 ESR 表达不足” 问题,经阿伏苯宗处理后,ESR 基因表达量提升 2.3 倍,囊胚植入率从 32% 提升至 78%,且胚胎形成羊膜腔的比例达 12.5%(未用药组仅 2.1%);而 RIF-29 患者因 “DNA 损伤修复基因 BRCA1 表达低”,血管加压素处理后,BRCA1 表达量提升 1.8 倍,子宫内膜细胞 DNA 损伤率下降 41%,囊胚入侵深度增加 53%。未来,患者无需再反复尝试不同治疗方案,通过一次样本检测,就能匹配到针对性药物,实现“一人一策”的精准治疗(图2)。
3. 检测更便捷,无需痛苦活检
模型仅需约 6500 个基质细胞、5000 个上皮细胞即可开展研究,而一次经血样本能提取约 2×10⁴个子宫内膜细胞,完全满足实验需求。相比传统子宫内膜活检(需通过宫腔镜取样,术后可能出现出血、感染风险),经血取样无创、无痛,患者接受度大幅提升。团队已验证:经血来源的子宫内膜细胞与活检样本的基因表达相似度达 94%,用其构建的 “人工子宫内膜”,囊胚植入率与活检样本构建的模型差异仅 5% 以内,确保检测结果的可靠性。
二、技术核心:为何能成功?—— 突破过往研究的三大困境
能实现上述临床突破,源于该团队跳出了过往研究的 “三大固定思路”,找到了建模的关键密码:
1. 从 “静态基质” 到 “动态组织” 重构子宫内膜模拟体系
此前包括西班牙的Ojosnegros团队和日本的Arima团队等在内的研究,多采用胶原蛋白、Matrigel 等合成基质模拟子宫内膜环境,这类基质仅能提供物理支撑,无法模拟子宫内膜的激素响应功能 —— 比如无法在雌激素、孕酮调控下进入 “种植窗期”,也不能分泌支持胚胎着床的关键因子(如 SPP1、LIF)。
该研究突破点:创新构建 “活的子宫内膜组织” endometrioid—— 从子宫内膜活检样本中分离上皮细胞和基质细胞,先将上皮细胞培养成能分化为腔上皮、腺上皮的类器官,再与基质细胞混合,加入 “Matrigel+MMP 可降解水凝胶” 的混合基质(比例经 27 次实验优化)。这种混合基质的杨氏模量约 184 Pa,与体内子宫组织硬度(171-250 Pa)高度吻合,且能支持细胞分泌功能 —— 经激素处理后,endometrioid 中雌激素响应基因 IHH 表达量提升 3.1 倍,孕酮响应基因 PAX8 表达量提升 2.8 倍,完全具备 “活的子宫内膜” 的功能。
2. 将胚胎发育模拟从 “胚胎附着” 阶段延伸至 “着床后” 关键时期
传统模型最多能观察到胚胎附着在基质表面,却无法支持胚胎进一步入侵、分化,因此无法判断 “胚胎能否真正发育”。
该研究突破点:通过微流控芯片构建 “分层培养体系”—— 底层为基础 ECM 凝胶,中层为 endometrioid 核心,上层为腔上皮单层,模拟体内子宫内膜的分层结构。这种体系不仅能让胚胎完成 “定位-附着-入侵” 的完整流程,还能支持植入后早期发育:囊胚植入后3天,可分化出合胞体滋养层(hCG 阳性)、绒毛外滋养层(HLA-G 阳性);7天后,能形成由OCT4 阳性细胞构成的原羊膜腔、GATA6 阳性细胞构成的原卵黄囊,相当于体内 10-12 天的发育阶段,这是过往模型从未实现的突破。
3. 首次解锁“胚胎-母体对话”密码,清晰解析植入调控机制
此前研究虽能观察到胚胎与子宫内膜接触,却无法明确两者间的信号交流 —— 比如胚胎分泌什么因子“告知”母体准备着床,母体又通过什么通路“回应”胚胎。
该研究突破点:通过单细胞RNA测序(scRNA-seq),解析了着床24小时(附着阶段)、72小时(入侵阶段)的“对话密码”。
附着阶段:胚胎的极性滋养层细胞会分泌 VEGFA、CGA 两种关键因子,分别与子宫内膜腔上皮细胞的 VEGFR1、FSHR 受体结合 ——VEGFA-VEGFR1 通路促进上皮细胞形成 “附着位点”,CGA-FSHR 通路抑制上皮细胞凋亡。若用抑制剂阻断这两个通路,囊胚附着率会下降 68%。
入侵阶段:胚胎的绒毛外滋养层细胞会分泌 MMP9,降解子宫内膜的 ECM,为入侵开辟通道;同时子宫内膜基质细胞会分泌 IGF1,促进滋养层细胞增殖。这种 “胚胎主动入侵、母体主动配合” 的动态对话,是首次在体外被清晰解析。
团队借助3D人工子宫与人工胚胎技术,实现了对着床全过程的动态再现与系统解析。“我们不仅‘看到’了,更开始‘理解’。”研究负责人表示,“这是人类第一次真正解读胚胎与母体间初始对话的语言,理解细胞是如何精确协作,共同完成‘安家’这一精密使命的。”
三、临床前景:辅助生殖进入“精准靶向”新时代
这项技术的落地,将彻底改变RIF的诊疗模式:
- 从“盲目尝试”到“精准定位”:过去RIF治疗多依赖医生经验,如今通过芯片模型可明确病因,针对性治疗;
- 从“广谱用药”到“个性化匹配”:千种药物精准筛选,避免无效治疗带来的经济负担和身心压力;
- 从“创伤检测”到“无创便捷”:未来经血样本即可完成检测,大幅降低诊疗门槛。
对于整个生殖医学领域而言,3D子宫模拟芯片不仅突破了伦理限制和技术瓶颈,更实现了基础研究与临床应用的无缝衔接。它既为科研人员解析胚胎着床机制提供了标准化“体外实验室”,也为临床医生提供了实用的诊疗工具,让辅助生殖技术从“经验驱动”迈入“科技精准驱动”的新阶段。
“这项工作打开的不仅是一个发育‘黑盒子’,更是一扇理解生命起源的窗口。”团队展望道,“这个人工子宫平台作为一项底层工具,将助力我们深入探索早期发育异常、妊娠并发症乃至部分先天疾病的起源。这仅仅是一个开始。前方的道路,通往的是对人类生命之初更系统、更深刻的认知,也孕育着守护生命健康的崭新可能。”
文章链接:https://doi.org/10.1016/j.cell.2025.10.026
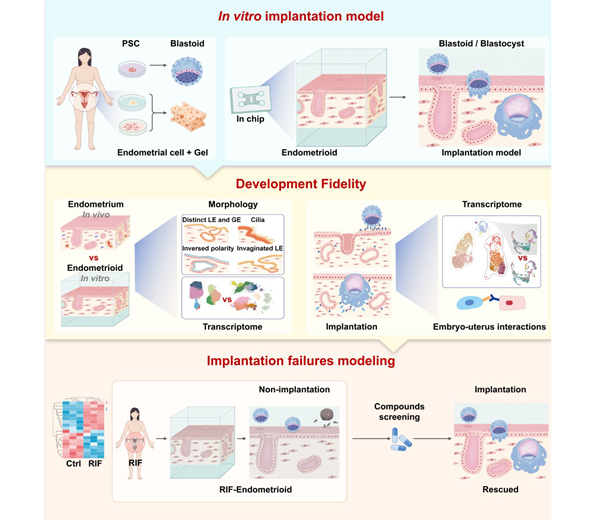
图1:人类植入和植入失败3D体外模型总览图
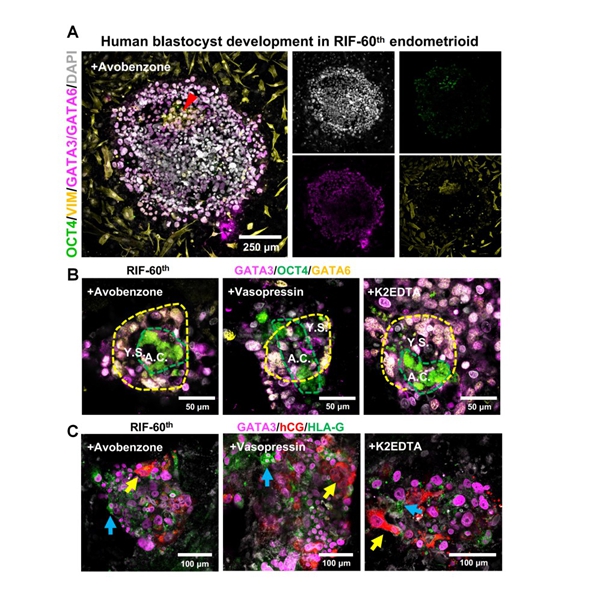
图2:自然胚胎在药物处理后RIF病人(60号病人)子宫模型中成功植入并发育
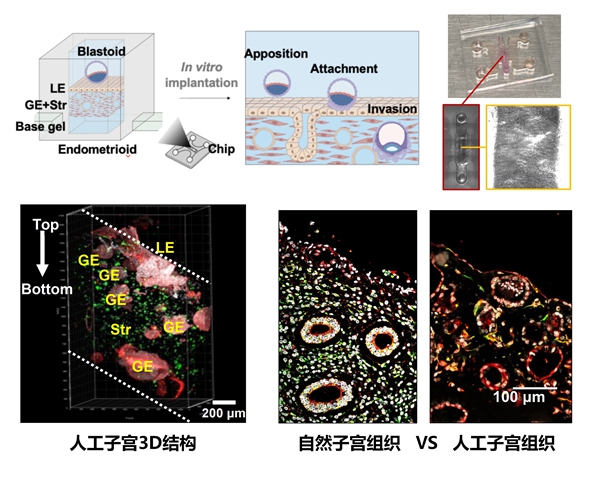
图3:体外构建人类3D“人工子宫”
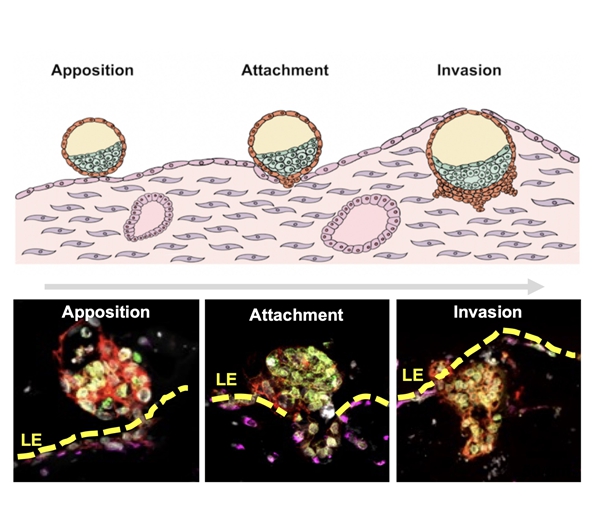
图4:首次实现人类胚胎着床全过程体外模拟
气候变化正在推动全球物种多样性和分布发生实质性变化,而荒漠生态系统被预测为最易受气候变化影响的生态系统之一。荒漠物种尽管已经进化出复杂的遗传、生理或是行为适应,但许多物种在其生理阈值附近持续生存。...

人类活动介导的外来物种入侵已成为造成全球生物多样性丧失的重要因素之一。其中,入侵捕食者作为食物链上游类群,对生物多样性的危害尤其严重。据统计,30种入侵兽类捕食者已导致全球596种鸟类、兽类和爬行动物濒...

2025年11月28日,由中国科学院动物研究所牵头发起的“声景中国(Soundscape China)”项目入选联合国《2024—2033科学促进可持续发展国际十年》计划(简称“科学十年”,英文IDSSD)。“科学十年”倡议是联合国大...

