魏妥团队合作开发器官和细胞双重特异性mRNA靶向递送技术
mRNA疗法因其研发周期短、生产成本低、制备工艺简单、起效快等多种优势,已被广泛应用于疫苗研发、蛋白替代疗法和基因编辑等领域。脂质纳米颗粒(Lipid Nanoparticle,LNP)是目前递送mRNA的最佳载体之一。然而,LNP的靶向递送能力尚存在限制,其在肝脏和肌肉递送方面已取得显著进展,但对肝外器官的靶向递送仍面临挑战。此前,我们开发了一种通用的器官选择性递送策略,简称Selective ORgan Targeting (SORT)技术(Nature Nanotechnology,2020)。通过在传统的四组分LNP中引入带有不同电荷的SORT脂质分子,可将mRNA特异性地递送至小鼠的肝脏、脾脏或肺部。然而,SORT技术仅局限于器官层面的靶向,尚无法实现对靶器官内特定细胞类型的选择性递送。
2024年10月10日,中国科学院动物研究所魏妥研究组与北京大学未来技术学院程强课题组合作,在Advanced Materials上发表了题为“Simplified Lipid Nanoparticles for Tissue- And Cell-Targeted mRNA Delivery Facilitate Precision Tumor Therapy in a Lung Metastasis Mouse Model” 的研究论文,该研究通过结合基于LNP的器官靶向递送和mRNA序列的受控表达,开发了一种器官和细胞双重特异性的mRNA-LNP递送平台,简称SELECT平台。该平台通过系统优化开发出三组分LNPs,可以将mRNA靶向递送到肺脏、肝脏和脾脏;通过在mRNA骨架中引入特定的microRNA(miRNA)靶点的反向互补序列,实现了mRNA在靶组织特定细胞类型中的受控蛋白质表达。
研究团队首先借助SORT技术获得了靶向肺部的五组分SM-102 LNP,然后通过正交实验对LNP组分进行优化。结果发现,与五组分和四组分LNP相比,去除磷脂DSPC和胆固醇的三组分LNP(Simplified targeted LNP,stLNP)在递送效率和器官特异性方面均表现更佳。stLNP不仅为靶向递送至肺脏、脾脏和肝脏提供了通用策略,而且大大简化了LNP的优化过程。此外,通过在mRNA骨架中引入miR-142的反向互补序列(miR-142ts),解决了肺靶向stLNP和肝靶向stLNP在脾脏器官中的表达泄漏问题,并分别提高了stLNP在肺脏和肝脏中的递送效率。
该研究进一步分析了肿瘤细胞与肺部正常组织细胞中miRNA的表达丰度差异,发现miR-126在肺部正常组织细胞中表达极高,而在肿瘤细胞中表达极低。借助细胞内源性miRNA的表达差异,研究团队将miR-142ts和miR-126ts双靶点整合到mRNA骨架中,显著降低了mRNA在肺部正常组织细胞中的表达,同时不影响其在肿瘤细胞中的高表达,从而提供了一种将mRNA精确递送到肺内肿瘤细胞的方法,将这一方法命名为SELECT(Simplified LNP with Engineered mRNA for Cell-type Targeting)。为了验证SELECT技术能否实现精准肿瘤治疗,研究团队筛选并合成了来源于人中性粒细胞的弹性蛋白酶(hELANE)mRNA,该靶点可以特异性杀伤肿瘤细胞,同时对正常细胞造成的损伤最小。miR142ts-126tsSELECT-hELANE在黑色素瘤肺转移模型中实现了针对肿瘤细胞的mRNA药物精准递送,并产生了高效的抑瘤效果。
该研究开发了一种简化LNP平台与工程化mRNA结合的精准肿瘤治疗策略,显著提高了mRNA疗法在肺转移肿瘤中的治疗效果。这一策略为实现精准肿瘤治疗提供了新的技术方向,具有广泛的临床应用潜力,也为针对其他特定细胞类型的mRNA疗法展现了广阔的应用前景。
北京大学未来技术学院程强研究员与中国科学院动物研究所魏妥研究员为论文的共同通讯作者,北京大学未来技术学院博士研究生费圆和中国科学院动物研究所博士研究生于晓璐为共同第一作者。该研究得到了国家重点研发计划和国家自然科学基金等项目资助。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202409812
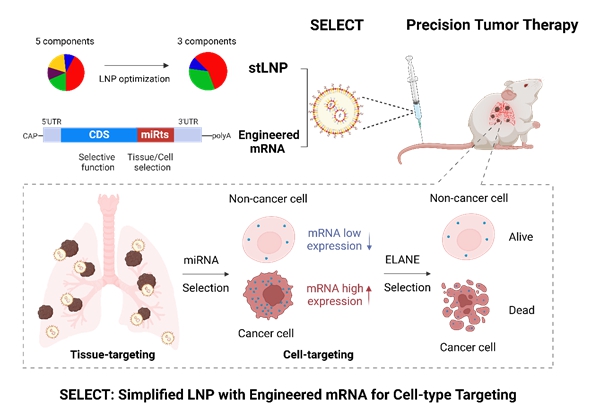
图1. SELECT技术介导器官和细胞双重特异性mRNA递送。
由蚊虫传播的疾病,如登革热和疟疾等,对全球健康构成了重大威胁。目前化学防控策略效果仅中等有效,长期使用易造成抗药性。因此,亟需探索新的蚊媒疾病防控新策略,以减少蚊媒疾病的传播风险。基因驱动和共生微...
在面对日益严峻的全球人口老龄化挑战之际,衰老及衰老相关疾病的研究已成为科学界和公众关注的焦点。衰老是一个复杂的生物学过程,它涉及从分子到细胞、组织、器官乃至整个生物体层面的多维变化。
新生或新发突变(de novo mutations, DNMs)指的是在父母生殖细胞或受精卵中,由于DNA复制(“复制驱动型”)或DNA损伤修复(“损伤诱导型”)自发产生并遗传给子代的突变。它为物种进化提供了“原材料”,也是许...

