焦建伟研究组揭示胚胎期小胶质细胞稳态调控神经发育的新机制
神经系统(CNS)作为一个高度复杂、精密有序的结构,从早期胚胎发育的开始,就伴随着非神经组织的驻留。其中,小胶质细胞(Microglia)作为神经系统的固有免疫细胞,它来源于卵黄囊中的原始巨噬细胞,并在胚胎大脑发育形成血管时侵入大脑皮层内,在神经前体细胞周围聚集形成一个特殊的微环境,并构建出独特的免疫状态。越来越多的证据表明小胶质细胞通过直接相互作用或间接分泌细胞因子的方式调控神经发生(Neurogenesis)、突触修剪等过程,对神经发育过程中的网络构建发挥着重要功能。尽管小胶质细胞在脑发育过程中扮演着越来越重要的作用,但是仍然缺乏系统性的研究胚胎期的小胶质细胞对于神经前体细胞命运决定的调控机制。
2022年7月20日,中国科学院动物研究所焦建伟研究团队在Molecular Psychiatry发表题为Microglia homeostasis mediated by epigenetic ARID1A regulates neural progenitor cells response and leads to autism-like behaviors的研究论文。该研究揭示了表观遗传因素ARID1A导致胚胎期小胶质细胞稳态失衡,造成神经前体细胞所处微环境的紊乱,进而损害神经发育的进程并导致自闭样行为的调控机制。
研究人员发现在胚胎期大脑神经发生过程中,小胶质细胞的稳态与神经前体细胞的维持和命运决定存在着重要的相互调控作用。其中,ARID1A作为SWI/SNF 染色质重塑复合体的核心亚基在小胶质细胞稳态重塑方面起着重要的调控作用。ARID1A缺失破坏了小胶质细胞中H3K9me3的表观修饰,导致小胶细胞稳态的失衡。随后失衡的小胶质细胞进一步通过改变神经前体细胞所处的微环境,损害了神经发生的过程,导致神经前体细胞库的耗竭和产生神经元的减少,进而导致成年小鼠产生了自闭样的行为缺陷。随后研究人员利用RNA-seq和CUT&Tag等基因组学方法,筛选出介导小胶质细胞与神经前体细胞“cross-talk”的分泌因子。小胶质细胞释放的PRG3因子通过驱动神经前体细胞内的Wnt/β-catenin 信号通路及其下游级联反应,从而导致了神经发生的紊乱。
该研究揭示了胚胎期神经发育过程之中,小胶质细胞的稳态与神经前体细胞相互作用的分子机理,将小胶质细胞作为胚胎神经发育内环境稳态调控的桥梁,在分子水平、细胞层面、双系统之间等多个层次,研究大脑皮层发育过程中不同系统之间体内微环境中细胞、分子的组成和网络结构,并深入探讨神经前体细胞在驻留免疫细胞环境下的自我更新和分化调控,为临床治疗提供理新的治疗方法和理论参考。

中国科学院动物研究所焦建伟研究员为该论文的通讯作者,博士后苏立波和博士研究生张梦甜为该论文的共同第一作者。该研究获得了国家科技部、国家自然科学基金委、中国科学院先导等项目的资助。
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
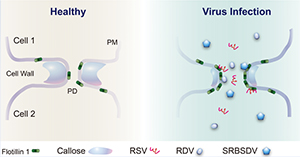
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

