点亮活细胞DNA:李幸团队综述“荧光点亮型”CRISPR荧光探针实现活细胞基因组高清成像
在活细胞中原位解析基因组DNA的动态行为,对揭示染色质三维结构、DNA相互作用、基因表达调控机制及DNA损伤和相关疾病的发生发展至关重要。然而,现有荧光成像技术在标记活细胞内的特定DNA序列时,普遍面临背景荧光干扰强、信噪比低的严峻挑战,极大限制了人们对基因组动态过程的精细观测。
2026年1月,中国科学院动物研究所李幸团队在国际学术期刊Cell Chemical Biology在线发表题为《Fluorogenic CRISPR for DNA imaging in live mammalian cells》论文。文章系统梳理并评述了荧光点亮响应型CRISPR(fluorogenic CRISPR, fCRISPR)成像探针在活细胞基因组DNA成像中的最新进展,为这一前沿领域提供了全面的技术概览与未来展望。
传统的CRISPR/Cas9衍生成像工具(如dCas9与荧光蛋白融合)虽已被用于DNA标记,但其“常亮”荧光特性导致未结合探针在细胞核内弥漫性分布,产生显著背景噪声,且易在核仁处非特异性聚集,严重制约成像分辨率与准确性。研究团队系统阐述了四种高效减噪的荧光响应型fCRISPR成像策略(图a)来解决这一问题,它们均具备“结合DNA时发光,未结合时不发光”的条件荧光特性,从而实现高信噪比、低背景的活细胞染色体动态示踪。
以下为四种点亮型fCRISPR探针的设计思路。在基于荧光响应蛋白的策略(图b)中,将荧光蛋白改造为可激活形式,仅在与dCas9共同靶向DNA位点时才发光,未结合时则被细胞蛋白酶体迅速降解,几乎无背景。荧光响应RNA适配体策略(图c)则是将Broccoli、Pepper等RNA适配体嵌入sgRNA,其在结合相应小分子染料后才发射荧光,实现DNA结合依赖的信号开启。分裂式荧光蛋白策略(图d)将荧光蛋白拆分为两个无荧光片段,分别与dCas9及sgRNA连接,仅当三元复合物在靶点形成时,蛋白片段重新组装并发光。分子信标策略(图e)则是在sgRNA上引入分子信标结构,未结合靶点时荧光被淬灭,结合后构象变化使荧光恢复。值得注意的是,上述技术均采用了荧光点亮RNA探针的设计思路,并将其整合进CRISPR系统,从而实现了对细胞内DNA的高效成像。
借助上述fCRISPR技术,研究人员已在多种人源活细胞中成功实现了包括单拷贝序列在内的高信噪比DNA成像,并揭示出染色体位点运动的异质性。例如,同一染色体上不同位点可呈现受限扩散或定向迁移等截然不同的运动模式,这些运动特性与基因转录活性密切相关。该技术还能通过端粒荧光强度无损评估端粒长度——癌细胞端粒信号明亮,衰老细胞信号暗淡,为衰老及相关疾病研究提供了非侵入性观测窗口。进一步地,fCRISPR技术与超分辨显微技术(如SIM、STED、STORM)结合,已实现纳米尺度染色质结构的解析;与光片显微镜联用,支持长时间活细胞成像且光毒性低;通过多重荧光标记方案,还能同时追踪多个基因组位点,助力染色体互作与空间组织研究。
总而言之,荧光响应型CRISPR成像技术以其高亮度、低背景、高信噪比和高时空特异性的优势,为在活细胞中实时、动态、多色观测基因组DNA提供了强大工具。这不仅深化了对染色质生物学及基因调控机制的理解,也为疾病机制研究、药物靶点筛选及未来诊疗策略开发奠定了方法学基础。
该论文的第一作者为万文瑾博士后和纪鑫博士后,通讯作者为中国科学院动物研究所的李幸研究员(最后通讯)和中国科学院杭州医学院的方晓红研究员。该研究受到国家自然科学基金、国家重点研发计划项目支持。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S2451945625003502?via%3Dihub
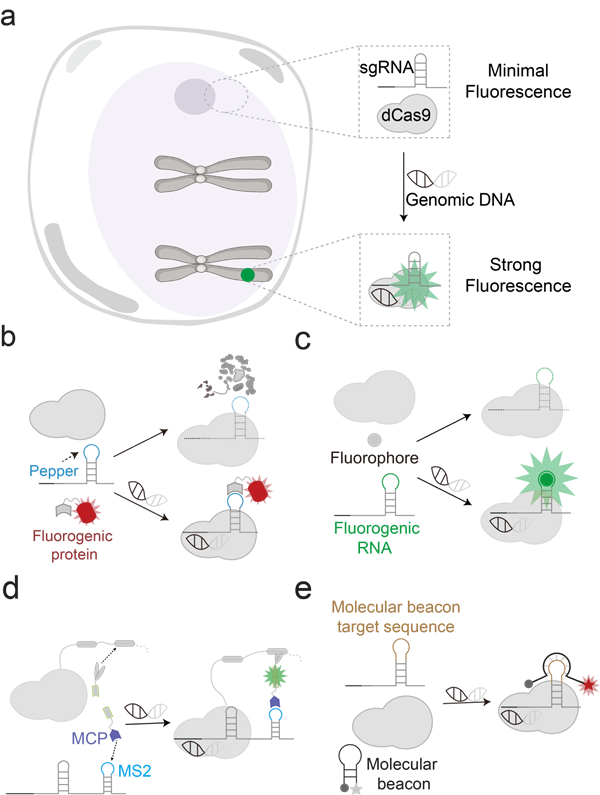
图1:荧光响应型CRISPR技术及其四种策略示意图
为熬过漫长寒冬,许多昆虫停止进食进入“滞育”。滞育期它们把代谢压到最低,并提前囤积大量脂肪,脂肪能否被高效动员与利用,直接决定滞育后期的存活率。线粒体是维持能量平衡的关键枢纽,影响细胞的生死。但滞...

野生蜜蜂是维系生态功能与粮食安全的关键传粉者,但其群落正遭受森林退化等人为活动的严重威胁。尽管大规模森林恢复被视为应对此危机的有效策略,但恢复过程中,树种多样性、森林结构与微环境如何共同驱动蜜蜂群...

近日,国际顶刊《Cell》发表一项改写辅助生殖格局的重磅研究——中国科学院动物研究所于乐谦、王红梅研究员联合美国德克萨斯大学西南医学中心吴军教授、中国农业大学魏育蕾教授,首都医科大学附属北京妇产医院杨...

