动物研究所细胞器稳态与疾病研究组合作发现线粒体外膜蛋白FUNDC2介导阿霉素引起的铁死亡和心肌损伤的机制
阿霉素(Doxorubicin)是目前临床上使用的一种广谱抗肿瘤药物,对多种肿瘤均有治疗作用。然而,阿霉素能引起扩张型心肌病伴心肌细胞死亡增强,严重时可导致心力衰竭,心脏毒性很大程度上限制了它在临床上的使用。铁死亡是一种近年来新发现的细胞程序性死亡形式,其主要标志是铁依赖的脂质过氧化的增加。研究表明,阿霉素能引起心肌细胞的铁死亡,同时铁死亡的抑制剂能明显减轻阿霉素的心肌毒性。细胞的细胞膜中产生抗氧化剂谷胱甘肽(GSH),会通过线粒体内膜的特定孔道蛋白SLC25A11(solute carrier family 25 member 11)被转移到线粒体中,发挥抗氧化功能。但是在铁死亡应激条件下,线粒体内的GSH水平是如何被调控的分子机制仍不清楚。FUNDC2是一个线粒体外膜蛋白,前期的研究表明其可能通过调控AKT信号通路参与缺氧诱导的血小板死亡调控,但是FUNDC2蛋白的其它功能及其在铁死亡中的作用有待进一步研究。
2022年8月29日,中国科学院动物研究所刘垒研究组与南开大学陈佺课题组联合在PNAS杂志上发表了题为 "Mitochondrial outer membrane protein FUNDC2 promotes ferroptosis and contributes to doxorubicin (DOX)-induced cardiomyopathy."的研究成果,详细阐明了线粒体外膜蛋白FUNDC2通过调控SLC25A11蛋白稳定性促进铁死亡,从而参与阿霉素诱导的心肌病的分子机制。
研究发现,尽管FUNDC2蛋白在心脏中表达量较高,但是 FUNDC2敲除的小鼠心脏功能正常。然而当利用阿霉素处理小鼠后,FUNDC2敲除的小鼠能够抵抗其引起的心脏功能下降和心肌纤维化,FUNDC2的敲除能抑制阿霉素引起心肌细胞线粒体形态的改变和铁死亡发生,提示FUNDC2在阿霉素引起的心肌损伤中发挥着重要作用。同时,细胞水平的研究也发现FUNDC2的敲除或敲减也能够抑制Erastin和阿霉素引起的铁死亡,而这种抑制作用与线粒体内的GSH含量密切相关。进一步的机制研究表明,FUNDC2与线粒体内膜的GSH转运蛋白SLC25A11有直接的互作,铁死亡刺激情况下,两者的互作增强,降低SLC25A11稳定性和二聚体的形成,引起线粒体内GSH含量下降,线粒体发生氧化损伤和形态功能异常,最终导致脂质过氧化和铁死亡;FUNDC2缺失后,SLC25A11蛋白稳定性增强,同时形成更多功能性的二聚体,使得线粒体内的GSH含量上升,从而能抵抗铁死亡的发生。
总之,该研究聚焦于线粒体外膜蛋白FUNDC2对阿霉素引起的铁死亡和心肌病调控,揭示了FUNDC2-SLC25A11轴通过调控线粒体GSH量参与铁死亡的分子机制;该研究有助于进一步理解线粒体稳态与铁死亡及相关疾病关系,对于相关疾病的预防和治疗提供了新的思路。
中国科学院动物研究所塔娜博士为本研究的第一作者,刘垒研究员和南开大学陈佺教授为并列通讯作者。该研究得到了国家自然科学基金委重大项目以及重大研究计划和科技部国家重点研发计划的支持。


图1 FUNDC2介导阿霉素引起的铁死亡和心肌病的模式图
人类活动和气候变化加速生物多样性的减少,导致物种范围的转移、收缩和扩张。在全球范围内,人类活动和气候变化已对生物多样性构成了严重威胁,目前已导致全球522种灵长类动物中约68%的物种面临灭绝风险。
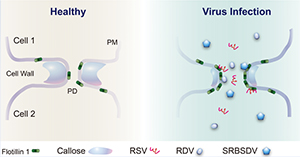
植物病毒素有“植物顽疾”之称,每年引起全球作物经济损失高达4000亿元。水稻作为人类重要的粮食作物之一,供给全世界一半以上的人口,主要种植于亚洲、非洲和南美洲等地区。

